calorimetria
Parte della termologia che si occupa della misurazione di quantità di calore e, in particolare, della determinazione dei calori specifici, dei poteri calorifici ecc.
C. fototermica Tecnica per misurare le proprietà termiche di un materiale attraverso l’analisi dell’andamento temporale della temperatura superficiale che si presenta a seguito dell’assorbimento di radiazione elettromagnetica modulata periodicamente in ampiezza.
Calorimetri
La c. utilizza differenti tipi di apparecchiature (calorimetri).
Per garantire corrette determinazioni calorimetriche deve essere ridotto al minimo il trasporto di calore dal calorimetro all’ambiente: in generale il flusso di calore Φ che si stabilisce fra il calorimetro e l’esterno è tanto maggiore quanto più grande è la differenza di temperatura ϑ e la conducibilità termica Λ del mezzo che li separa. Per un regime stazionario di temperatura, si ha: Φ=Λϑ. In questa equazione Λ rappresenta una caratteristica fondamentale che può servire a classificare i differenti tipi di calorimetro: quando Λ è molto piccola, il calorimetro è adiabatico, quando Λ è molto grande, il calorimetro è isotermo.
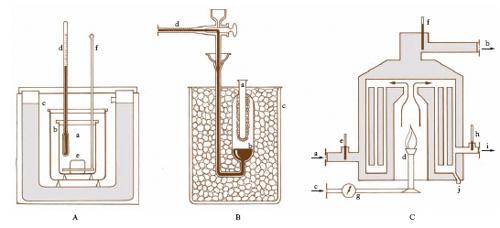
Nei calorimetri ad acqua, dei quali il tipo più semplice è quello dovuto a H.-V. Regnault, modificato poi da P.-E. Berthelot (fig. A), si determina la quantità di calore ceduta dal corpo in esame attraverso l’innalzamento di temperatura che subisce una massa nota di acqua in cui il corpo medesimo sia immerso (metodo delle mescolanze). In un recipiente a che può considerarsi adiabatico (a ciò provvedono i recipienti b, a pareti isolanti, e c, a pareti speculari) sia contenuta una massa m di acqua alla temperatura t1 (misurata dal termometro d) e vi si immerga un corpo e di massa M alla temperatura t2>t1. Dopo un certo tempo corpo e acqua (rimescolata mediante l’agitatore f) assumono una stessa temperatura t3, essendo: t2>t3> t1; se c è il calore specifico del corpo, dovendo la quantità di calore da esso ceduta risultare uguale a quella acquistata dall’acqua, si ha, indicando con C il calore specifico dell’acqua, (t3−t1) C m = c M (t2−t3), da cui si ricava c.
Nel calorimetro a ghiaccio, perfezionato da R.W. Bunsen, la quantità di calore ceduta da un corpo viene invece valutata misurando la quantità di ghiaccio che si fonde (fig. B): l’etere introdotto nella provetta a viene fatto rapidamente evaporare; ciò provoca il congelamento di parte dell’acqua contenuta nel bulbo b, immerso nel termostato a ghiaccio c, con formazione di uno straterello di ghiaccio intorno ad a. Introdotto allora in a il corpo sul quale si vuole effettuare la misura calorimetrica, accade che per la fusione di una parte del ghiaccio intorno ad a (se il corpo è a temperatura t > 0 °C) o per la solidificazione di altra acqua (se t 〈 0) il menisco del mercurio lungo la graduazione d si sposta. Dalla variazione di volume che si legge si risale alla quantità di ghiaccio che si è fusa o si è formata e di qui, noto il calore di fusione del ghiaccio, alla quantità di calore ceduta dal corpo al calorimetro. Si noti che nei calorimetri a ghiaccio la valutazione della quantità di calore non richiede misure di temperature.
Su diverso principio sono fondati i calorimetri elettrici (W.H. Nernst, A.T. Eucken), usati soprattutto per determinazioni di calori specifici a temperature bassissime. Si fa percorrere da una corrente elettrica un sottile filo di platino che attraversa il corpo in esame e si misura l’energia elettrica dissipata nel corpo sotto forma di calore; si misura contemporaneamente la variazione di resistenza del filo e quindi la sua variazione di temperatura, pari a quella del corpo; nota la massa del corpo è allora noto il suo calore specifico.
Il potere calorifico dei gas combustibili si può determinare con il calorimetro di Junkers (fig. C). In questo, una corrente continua e costante di acqua, proveniente da a e uscente da b, viene riscaldata facendo bruciare il gas, proveniente da c, nel bruciatore d: dall’aumento di temperatura (ricavato dalle indicazioni dei termometri e, f) che una quantità nota di acqua, attraversando l’apparecchio, subisce in un determinato intervallo di tempo, e dal simultaneo consumo di gas bruciato, misurato dal contatore g, si risale al potere calorifico. Per misure precise occorre tenere conto sia della temperatura, indicata da h, dei prodotti della combustione, uscenti da i, sia della quantità d’acqua di condensazione che esce da j.
In fisica delle particelle elementari, i calorimetri sono impiegati per misurare l’energia delle particelle: essi sono costituiti da un blocco unico di materiale (calorimetro omogeneo) o da una serie di strati di materiale inerte alternati con strati di materiale sensibile, per esempio uno scintillatore, e da opportuni sistemi di lettura e di acquisizione (calorimetro a campionatura). Oltre all’energia, è possibile determinare la natura e, spesso, il punto di impatto e la direzione di una particella incidente. Poiché gli sciami prodotti da elettroni, positroni e fotoni sono diversi da quelli prodotti dagli adroni, per i primi si usano i calorimetri elettromagnetici, per i secondi i calorimetri adronici.
Analisi calorimetrica
È l’analisi basata sulla determinazione del potere calorifico di un gas, effettuata mediante l’impiego di un calorimetro. L’equazione base è la: xn=(m+m′)cΔt−λa, dove x è il potere calorifico molare, n il numero di moli di gas bruciate, m la massa di acqua nel calorimetro, m′ l’equivalente di questo in acqua, c il calore specifico dell’acqua, Δt la differenza di temperatura rilevata nel calorimetro, λ il calore latente molare di condensazione e a il numero di moli d’acqua formatosi nella combustione e poi nella condensazione.
Fisiologia
In fisiologia sperimentale si fa ricorso a metodi calorimetrici soprattutto per lo studio del ricambio energetico e delle sue variazioni. Per la determinazione del calore prodotto da organismi animali in varie condizioni, sono stati realizzati calorimetri di grandi dimensioni. Il tipo più noto è dovuto a W.O. Atwater, W.C. Rose e a F.G. Benedict. È costituito da una piccola stanza protetta da materiale coibente, nel cui interno può soggiornare un uomo; la temperatura vi è mantenuta costante da una massa d’acqua che, scorrendo in appositi tubi, asporta il calore prodotto; la differenza tra la temperatura dell’acqua all’uscita e all’ingresso, moltiplicata per la massa dell’acqua stessa, permette di calcolare la quantità di calore scambiata dall’uomo con l’ambiente.