combustione
Rapida reazione di ossidazione di una sostanza, detta combustibile, da parte di un agente ossidante, il comburente, accompagnata da un elevato sviluppo di calore e spesso di luce. Nella maggior parte delle c. il comburente è costituito dall’ossigeno dell’aria, ma in alcuni casi può essere diverso, per es. se si brucia il rame nei vapori di zolfo e l’idrogeno in un ambiente di cloro.
Tipi di combustibile
I combustibili possono essere solidi, liquidi o gassosi, naturali o artificiali. Combustibili solidi naturali sono il legno, la torba, la lignite, il litantrace, l’antracite, gli scisti bituminosi, i calcari bituminosi, il cannel coal, il boghead coal, l’ozocerite; combustibili solidi artificiali sono il carbone di legna, il coke, il semicoke. Combustibili liquidi naturali sono il petrolio e il bitume; combustibili liquidi artificiali si ottengono dal frazionamento del petrolio o dai trattamenti (cracking, reforming ecc.) fatti subire a queste frazioni; oltre ai combustibili liquidi derivati da petrolio (benzine, oli combustibili ecc.) si possono ricordare gli oli vegetali, l’alcol metilico, l’alcol etilico, i liquidi impiegati nella propulsione a razzo. Combustibili gassosi naturali sono i gas naturali e i gas di miniera; combustibili gassosi artificiali sono il gas di città, il gas d’altoforno, il gas dei forni a coke, il gas d’aria, il gas d’acqua, il gas doppio, il gas d’olio, l’acetilene, l’ossido di carbonio, l’idrogeno; i combustibili gassosi artificiali si possono ottenere nella trasformazione dei combustibili solidi o liquidi (talora anche di quelli gassosi) attraverso processi di pirolisi, idrogenazione, conversione ossidante ecc., che possono tendere a una valorizzazione del combustibile d’origine o alla produzione di un combustibile di migliore utilizzazione, atto a bruciare con rendimento più elevato. Altre sostanze (per es., zolfo, alluminio), pure combustibili, vengono però impiegate solo in casi speciali, a causa del loro costo elevato (così, lo zolfo nei calcaroni siciliani, l’alluminio nell’alluminotermia).
I combustibili gassosi possono essere bruciati in due modi: a) mescolandoli all’aria prima dell’accensione (come nei bruciatori Bunsen e nei motori a gas); b) facendo avvenire la mescolanza progressivamente durante la c.: un getto di gas combustibile viene immesso nell’aria come nei sistemi di illuminazione a gas e negli apparecchi domestici, oppure l’aria e il gas combustibile vengono addotti ambedue, mediante tubi separati, nella camera dove si svolge la c., come nella maggior parte delle applicazioni industriali. La c. è tanto migliore quanto più perfetta è la mescolanza del combustibile con l’aria, il che avviene più facilmente con i combustibili gassosi. Questi offrono altri vantaggi: a) produzione in un centro e distribuzione in una vasta zona circostante di un prodotto (per es., il gas per usi domestici) di composizione uniforme e pressione costante; b) impiego di una quantità d’aria assai vicina a quella teorica; c) facilità di regolazione del flusso del combustibile; d) c. senza fumo e senza ceneri; e) facilità di recupero del calore (nelle applicazioni industriali).
I combustibili liquidi trovano largo impiego (oli combustibili densi) negli impianti a focolare e (oli combustibili leggeri, benzine ecc.) nei motori a c. interna.
I combustibili solidi si trovano in maggiore quantità e per lungo tempo furono i soli usati nei processi di combustione. Anche oggi, nonostante la rilevante parte destinata alla distillazione e alla gassificazione, vengono usati su larga scala per la c. diretta, questa può svolgersi per iniezione di materiale polverizzato oppure, secondo l’uso più diffuso, su griglia. Vengono usati tal quali o dopo processi di depurazione (lavaggio, flottazione).
Reazioni di combustione
Il fenomeno della c. fu variamente spiegato nei tempi antichi. All’inizio del 18° sec. era diffusa la teoria del flogisto in base alla quale i corpi combustibili contenevano un ‘principio comune’, presente in vario grado, che all’atto della reazione si liberava sotto forma di calore formando la fiamma. Alla fine del 1700 A.L. Lavoisier dimostrò sperimentalmente che l’aria è un miscuglio di ossigeno e di azoto e che la c. è un fenomeno d’ossidazione nel quale l’ossigeno agisce da comburente mentre l’azoto non prende parte alla reazione.
I combustibili fluidi, gassosi e liquidi, sono prevalentemente idrocarburi e quindi costituiti da carbonio e idrogeno. I combustibili solidi, fra i quali predomina il carbone, contengono anche quantità variabili di sostanze minerali che vanno a formare le ceneri. La c. del carbonio nell’aria porta alla formazione di anidride carbonica secondo la reazione:
C+O2→CO2
In difetto di ossigeno è accompagnata dalla reazione:
2C+O2→2CO
dalla quale si ottiene ossido di carbonio. Le reazioni globali attraverso le quali dagli idrocarburi si formano i prodotti di c., liberando quantità significative di energia termica, si scrivono per il metano:
CH4+2O2→2H2O+CO2
per un generico idrocarburo
CnHm+(n+m/4)O2→nCO2+(m/2)H2O
Nella c. dell’idrogeno si forma acqua, e la reazione si può scrivere:
2H2+O2+4N2→2H2O+4N2
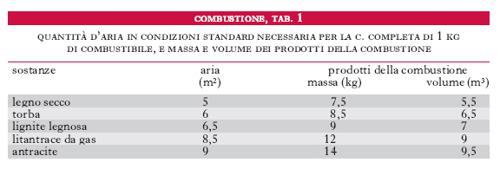
Le reazioni precedenti permettono di calcolare, per ogni combustibile formato di carbonio e idrogeno in proporzioni note, la quantità d’aria teorica necessaria per la c. completa, nonché il volume dei fumi che si formano (tab. 1).
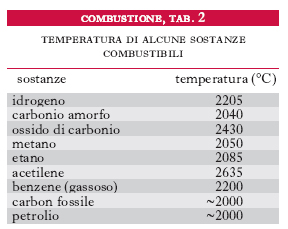
La quantità di calore che si sviluppa nella c. dell’unità di massa di un combustibile prende il nome di potere calorifico del combustibile stesso. La temperatura che si può raggiungere ( temperatura di c.) dipende dalla quantità di calore sviluppato e dalla massa e dal calore specifico dei prodotti della c. (tab. 2). L’utilizzazione del calore sviluppato dai combustibili è tanto maggiore quanto minore è la quantità di calore sensibile dei gas combusti che escono dall’apparecchio di utilizzazione. Soltanto quando la temperatura ha raggiunto un determinato valore (temperatura d’ignizione), la velocità della reazione di c. risulterà sufficientemente elevata da innescare il processo di ignizione. La propagazione della c. ha luogo infatti quando la quantità di calore prodotta per unità di tempo nell’ossidazione del combustibile è maggiore di quella asportata, sempre per unità di tempo, per convezione dall’aria comburente e per irraggiamento.
Processi di combustione
Dal punto di vista chimico la c. in fase gassosa procede attraverso una successione di reazioni a catena. L’iniziazione della catena è dovuta alla formazione di specie attive (atomi o radicali liberi), le quali reagiscono con altre molecole di reagente per dare prodotti e altre specie attive, che a loro volta proseguono la catena di reazioni. La terminazione si verifica nel momento in cui le specie attive reagiscono tra loro in fase gassosa o vengono adsorbite su superfici solide, per dar luogo a molecole stabili.
L’accensione omogenea (o autoaccensione) ha luogo uniformemente in tutta la massa gassosa, quando questa abbia raggiunto la temperatura d’ignizione (per es., dopo immissione in recipienti a pareti calde o mediante compressione adiabatica). L’accensione localizzata è provocata con archi elettrici o scintille.
Perché la c. si propaghi occorre che nella miscela la quantità relativa di gas combustibile e comburente sia compresa tra due limiti, detti limite inferiore e limite superiore d’infiammabilità. Essi variano con la temperatura e con la pressione della miscela e sono anche influenzati dal campo di moto della corrente fluida, per cui non possono essere considerati come una proprietà chimico-fisica della miscela stessa.
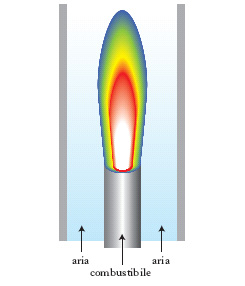
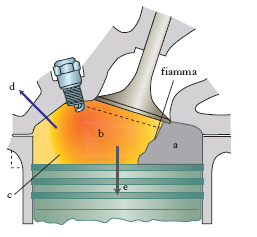
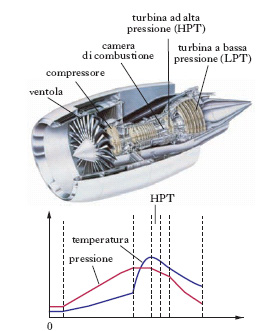
La peculiarità dei processi di c. deriva dall’interazione di fenomeni fisici e chimici che danno origine a particolari e diversificate situazioni. Nei fluidi in moto si possono distinguere due tipi di fiamme: premiscelate e a diffusione. Nelle prime la miscela gassosa di ossigeno, o aria, e combustibile fluisce in un condotto tubolare. L’evento reattivo che dà luogo alla fiamma si manifesta in un sottile spessore che identifica il fronte di reazione che procede nella direzione opposta a quella del fluido. La temperatura subisce un’impennata mentre ha luogo anche una brusca diminuzione della concentrazione dei reagenti che si trasformano nei prodotti di reazione. Nelle fiamme a diffusione, come illustrato nella fig. 1, i due reagenti convergono verso la zona in cui avviene la reazione, e la velocità del processo è soprattutto determinata da quella di trasporto dei reagenti. In entrambi i casi si devono distinguere due ulteriori situazioni corrispondenti al fatto che il moto delle correnti sia rispettivamente di tipo laminare o turbolento poiché nel primo caso i processi di mescolamento avvengono solo su scala molecolare, mentre nel secondo sono dovuti anche all’azione dei vortici turbolenti. Per es. nel cilindro di un motore a c. interna (motore a scoppio) una miscela di benzina e aria, viene compressa sino a raggiungere la temperatura di ignizione, in corrispondenza della quale si innesca un fronte di c. che si propaga nella camera stessa (fig. 2). Viceversa in una candela, la cera di cui è costituita si vaporizza per il calore liberato dalla fiamma e viene così a contatto con l’aria nella zona prossima allo stoppino, dove ha luogo il processo di c., che acquista così le caratteristiche tipiche di una fiamma a diffusione. Altri esempi di fiamme a diffusione sono presenti negli ugelli dei bruciatori o nei motori a reazione degli aerei, di cui viene illustrata una tipica struttura nella fig. 3.
Nei processi di c. eterogenea si utilizzano come combustibili le particelle di un solido, per es. il carbone, o le goccioline di idrocarburi liquidi. Nel primo caso la reazione avviene per interazione delle molecole di ossigeno con gli atomi di carbonio che costituiscono il materiale solido. In questo caso i processi diffusivi che hanno luogo nel film gassoso adiacente alla superficie del solido influenzano in modo significativo la cinetica del processo stesso di combustione. Ancora più complessa è la c. delle gocce di un liquido poiché il riscaldamento dovuto alla reazione provoca la parziale evaporazione dei componenti liquidi volatili che diffondono nella fase gassosa, reagendo con l’ossigeno.
C. a carattere esplosivo
Si riscontrano quando centri di fiamma si propagano spontaneamente con forte sviluppo di calore in tutta la massa gassosa con velocità subsonica (deflagrazione) o supersonica (detonazione). Le proprietà chimiche del sistema, la temperatura iniziale, la forma e le dimensioni del recipiente caratterizzano l’intensità della deflagrazione e la sua eventuale degenerazione in detonazione. Un ruolo rilevante nella transizione dalla deflagrazione alla detonazione è svolto dai moti del gas che vengono indotti dalla combustione (➔ esplosione).