elemento
Biologia
Elemento genetico
trasponibile Unità genetica in grado di inserirsi in un cromosoma, uscirne e reinserirsi successivamente in una diversa posizione. Con tale locuzione sono altresì indicate le sequenze di inserzione, i trasposoni, alcuni batteriofagi e gli elemento di controllo, capaci di rendere un gene bersaglio mutante instabile. Gli elementi di controllo sono stati identificati nei primi anni 1950 da B. McClintock.
Elemento intensificatore (enhancer)
Sequenza di DNA virale, che aumenta l’efficienza della trascrizione e può funzionare situata sia a monte sia a valle del promotore.
Chimica
Elementi chimici
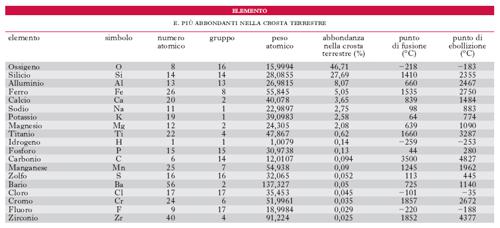
Sostanze semplici, cioè in cui tutti gli atomi costituenti, presi singolarmente, hanno uguale il numero e la disposizione degli elettroni, ma possono differire per la massa (proprietà denominata isotopia). Sono i costituenti di tutte le sostanze conosciute (tab.).
Cenni storici
La dottrina aristotelica dei quattro elementi, ovvero la terra, l’acqua, l’aria e il fuoco, riconosciuti come i principi costituenti di tutte le sostanze dominò gran parte del periodo alchemico. Il primo tentativo organico di critica alla dottrina aristotelica fu operato da Paracelso (1493-1541), il quale formulò la teoria dei tria prima, secondo la quale i costituenti della materia sarebbero stati lo Zolfo, il Mercurio e il Sale. Anche se tale dottrina prendeva spunto dalle fondamentali operazioni chimiche di combustione e distillazione, i tria prima non rappresentarono una reale rottura con il passato. In effetti, si accentuava la connotazione metafisica del concetto di elemento, tanto che il loro concreto isolamento rappresentava un’operazione non solo materialmente, ma anche concettualmente impossibile. Per Paracelso, per es., il comune mercurio metallico rappresentava solo una realizzazione corrotta e imperfetta del Mercurio dei tria prima.
Solo nel 17° sec., con l’affermazione della filosofia meccanicistica e della fisica newtoniana, la teoria aristotelica entrò in crisi: in particolare R. Boyle (1627-1691) la attaccò, dimostrandone l’inconsistenza sperimentale e affermando che le sostanze differiscono tra loro per dimensioni, forma, disposizione e movimento delle particelle che le costituiscono. L’ipotesi particellare, che rappresentava in realtà un rifiuto dell’idea di elemento poiché la materia veniva assunta unica e omogenea, dominò il 16° sec. e la prima parte del 17°, anche se alcuni chimici come N. Lemery (1645-1715) cercarono di conciliare i principi aristotelici e quelli di Paracelso con la teoria meccanicistica.
Tra la fine del 17° sec. e gli inizi del 18° si sviluppò un approccio alla problematica chimica diverso, per molti aspetti in antitesi, da quello corpuscolare meccanicistico. Il maggior esponente di questa tendenza fu G.E. Stahl (1660-1734), il quale elaborò la teoria del flogisto. La svolta decisiva si ebbe però con A.-L. Lavoisier (1743-1794), che pose al centro delle sue ricerche l’analisi chimica, rifiutando programmaticamente qualunque sistema di elementi che non risultasse compatibile con l’esperienza. Per Lavoisier un elemento era una sostanza che non è possibile decomporre mediante l’analisi. Questa definizione operativa non ha impedito però che sostanze ritenute elementari si rivelassero successivamente dei composti: per es., nella sua tavola degli elementi, Lavoisier inserì le terre alcaline (ossidi di potassio e di sodio) anche se ne sospettava la natura composta.
Nella teoria atomica, introdotta successivamente da J. Dalton (1766-1844), ciascun atomo è caratterizzato da una diversa densità. Con ciò venne data una base fisica alla definizione operativa di Lavoisier e si riuscì a rendere conto del fatto che in una reazione gli elementi si conservano anche se le loro proprietà macroscopiche non appaiono nei composti da loro formati. Agli elementi noti al tempo di Lavoisier le ricerche elettrochimiche della prima metà del 19° sec. ne aggiunsero un’altra quindicina; successivamente si ebbero nuove scoperte in seguito all’introduzione dei metodi spettroscopici (1860-63) e con l’introduzione da parte di D.I. Mendeleev del sistema periodico degli elementi. Gli ulteriori apporti sono dovuti allo studio dei gas rari (1894-98), alla radioattività, all’applicazione dello spettrografo di massa, agli elementi prodotti artificialmente per trasmutazione nucleare.
Il sistema periodico di Mendeleev
Il sistema di classificazione oggi universalmente adottato è fondamentalmente quello proposto da Mendeleev nel 1869. Già in precedenza si erano avuti numerosi tentativi per classificare gli elementi chimici in base a leggi di periodicità. Si possono ricordare il tentativo di J.W. Döbereiner che aveva mostrato (1817) l’esistenza di triadi di elementi simili (quali, per es., cloro, bromo, iodio; calcio, stronzio, bario; litio, sodio, potassio; ecc.). Successivamente furono trovate altre triadi e anche aggruppamenti di più di tre elementi; così, si vide che ossigeno, zolfo, selenio, tellurio e azoto, fosforo, arsenico, antimonio formano famiglie uniche. Un tentativo posteriore fu quello di A.-E. de Chancourtois, che verso il 1862 propose di disporre gli elementi chimici noti in ordine crescente di peso atomico lungo una spirale. Adottando come passo dell’elica 16 unità di peso atomico, gli elementi aventi proprietà simili si venivano a trovare in punti vicini nella successione. L’idea della possibilità di una classificazione degli elementi si andava però facendo strada e alcuni anni più tardi, quando si affermò il criterio di determinazione dei pesi atomici introdotto da S. Cannizzaro, Mendeleev, riassumendo e sintetizzando ciò che di buono c’era nei tentativi precedenti, dispose gli elementi in base al peso atomico e alla forma limite di combinazione in una tavola formata da linee verticali (gruppi) e orizzontali (periodi). Quasi contemporaneamente J.L. Meyer propose una classificazione molto simile.
Nonostante le diffidenze iniziali, il sistema proposto da Mendeleev si dimostrò ben presto di fondamentale importanza per gli sviluppi della chimica, dai quali il sistema stesso ricevette continuamente conferme e appoggi. Successivamente alla formulazione del sistema periodico da parte di Mendeleev, furono scoperti gli elementi elio, neo, argo, cripto, xeno e radon, tutti caratterizzati da una spiccata inerzia chimica, cioè da una quasi nulla tendenza a combinarsi con altri elementi. Tali gas, detti rari, non potevano trovare posto nel sistema inizialmente costruito comprendente sette gruppi; perciò, date le loro particolari caratteristiche chimiche, furono ordinati in un unico gruppo che viene posto a destra nella tabella degli elementi. Il sistema di Mendeleev ha inoltre permesso di predire l’esistenza di numerosi elementi, stabilendo a priori le proprietà, sia chimiche sia fisiche, loro e dei loro composti, in base al principio che le proprietà di ciascun elemento sono intermedie tra quelle degli elementi che lo circondano nella tabella. Tali elementi, allora non conosciuti, sono stati più tardi riscontrati in natura o preparati artificialmente: così, per es., lo scandio (ekaboro), il gallio (ekaalluminio), il germanio (ekasilicio), il tecnezio (ekamanganese), il renio (dvimanganese) e il polonio (ekatantalio).
Il sistema periodico di Mendeleev trovò una piena giustificazione fisica nelle conoscenze sulla struttura atomica che si svilupparono agli inizi del 20° secolo. Con le ricerche di A. van den Broek (1911) e soprattutto di H.G.J. Moseley (1913) si scoprì che la posizione occupata da un elemento nel sistema periodico corrispondeva al numero atomico (numero di elettroni nell’atomo), cioè a una proprietà intrinseca dell’atomo. Il numero atomico sostituì così il peso atomico come criterio ordinativo degli elementi e in tal modo fu possibile risolvere alcune incongruenze del sistema di Mendeleev, come l’inversione nella disposizione di alcuni elementi (iodio-tellurio, argo-potassio, cobalto-nickel) rispetto al peso atomico, dovuta alla loro composizione isotopica. L’introduzione nel sistema periodico di una grandezza come il numero atomico che aumenta sempre di un valore unitario consentì inoltre di definire con esattezza il numero di elementi ancora mancanti: in particolare ciò si rivelò importante nella previsione del numero degli elementi delle terre rare, collocati da Mendeleev in una unica casella per via delle loro strette analogie chimiche e, per tale motivo, difficili da isolare e riconoscere chimicamente. La struttura elettronica per livelli introdotta da N. Bohr (1913) permise di associare la valenza alla struttura elettronica esterna in modo che la periodicità delle proprietà chimiche risultò dipendere dalla periodicità con cui i diversi atomi presentano lo stesso numero di elettroni sul livello più esterno.
Il sistema periodico moderno
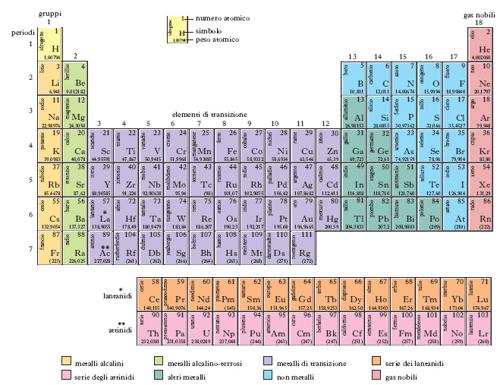
La tavola qui riportata (fig. 1) costituisce la forma più comunemente usata per questa classificazione; in essa ogni elemento è indicato con il simbolo corrispondente: in alto è il numero atomico Z, sotto è il peso atomico. Disponendo gli elementi nell’ordine dei numeri atomici crescenti si rileva che, dopo un certo numero di termini, ricompaiono elementi aventi proprietà analoghe a quelli precedentemente ordinati. La tavola degli elementi risulta così costituita da colonne in cui sono inseriti gli elementi appartenenti a un medesimo gruppo e da righe, ognuna rappresentante un periodo. La periodicità può aversi dopo un numero diverso di elementi; osservando la tavola si vede infatti che si hanno due periodi piccoli, con 8 elementi, due periodi grandi con 18 elementi ciascuno, uno con 32, e un ultimo periodo incompleto.
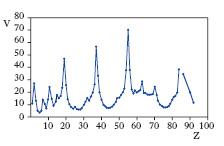
Lungo ciascun periodo le proprietà chimiche e fisiche degli elementi vanno gradualmente variando: ciò si vede anche graficamente, riportando in ordinate le singole proprietà considerate e in ascisse il numero atomico. La fig. 2, per es., fa vedere le periodicità con le quali varia il volume atomico (cioè il peso atomico diviso la densità) dei vari elementi. Ciascun periodo comincia con un metallo molto reattivo (metallo alcalino), poi, attraverso elementi metallici sempre meno reattivi, si giunge a elementi con proprietà non metalliche, che si affermano spiccatamente negli elementi con cui termina ciascun periodo (alogeni). In particolare, lungo un periodo varia la valenza dei composti ossigenati al massimo grado, così per gli elementi del 2° piccolo periodo tali ossidi sono: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Invece la valenza rispetto all’idrogeno in ciascun periodo (escludendo gli elementi di transizione) sale prima fino a 4 e diminuisce poi di nuovo fino a 1.
I gruppi sono numerati progressivamente a partire dai metalli alcalini fino ai gas nobili. Tuttavia viene ancora ampiamente utilizzata una notazione che deriva dall’originale tabella di Mendeleev, nella quale ogni gruppo di elementi, individuato dalla particolare forma di combinazione con l’ossigeno (cioè dalla valenza) era suddiviso in due sottogruppi (A e B) in modo che risultassero nel medesimo sottogruppo solo gli elementi con proprietà chimiche simili. Così, il primo gruppo, che comprendeva i metalli non-covalenti, era suddiviso nei sottogruppi IA, formato dai metalli alcalini, e IB, formato dai metalli nobili rame, argento e oro. Con l’introduzione del sistema periodico lungo questa suddivisione non ebbe più ragion d’essere, ma si sono conservate le denominazioni dei gruppi di appartenenza dei vari elementi.
La posizione occupata da un elemento nel sistema periodico può essere interpretata, a livello atomico, sulla base della disposizione degli elettroni negli orbitali atomici. Come è noto la meccanica quantistica consente di stabilire i valori delle energie dei vari livelli quantici che caratterizzano gli orbitali. Tramite il principio di esclusione di Pauli e quello della massima molteplicità di Hund è possibile procedere al progressivo riempimento degli orbitali atomici (criterio dell’Aufbau) e determinare i livelli occupati dagli elettroni di ciascun atomo nello stato fondamentale. In tal modo si può verificare la stretta correlazione tra la periodicità delle proprietà chimiche e la periodicità della struttura atomica. Così l’idrogeno (Z=1) e l’elio (Z=2) completano il primo livello quantico principale, costituito da un solo orbitale di tipo s. Con il litio (Z=3) si inizia il riempimento del secondo livello che termina con il neo (Z=10): ciò corrisponde al fatto che gli elementi dal litio al neo appartengono tutti al medesimo periodo. Gli atomi degli elementi dal sodio (Z=11) all’argo (Z=18) sono invece caratterizzati dal riempimento del terzo livello quantico principale. Il quarto periodo incomincia con il potassio (Z=19) e il calcio (Z=20) a questo punto la carica nucleare è tale da far occupare ai successivi elettroni gli orbitali d appartenenti al livello quantico inferiore. Il riempimento del quarto livello viene perciò interrotto con l’inserimento di 10 elettroni negli orbitali 3d dallo scandio (Z=21) allo zinco (Z=30) dopo il quale si ha il gallio (Z=31) con cui riprende il riempimento del quarto livello che termina con il cripto (Z=36); in effetti, il quarto periodo del sistema periodico è caratterizzato da 18 elementi, per l’inserimento della prima serie di 10 elementi di transizione. Il quinto livello, dal rubidio (Z=37) allo xeno (Z=54) ha un andamento analogo al precedente, con l’inserimento degli elementi appartenenti alla seconda serie di transizione, dall’ittrio (Z=39) al cadmio (Z=48), che corrispondono al riempimento degli orbitali 4d. Il sesto livello incomincia con il cesio (Z=55) e presenta un ulteriore inserimento di 7 orbitali 4f, appartenenti cioè a un livello quantico principale più interno: si ha così la comparsa di una nuova serie di 14 elementi, chiamati terre rare (o lantanidi), che va dal cerio (Z=58) al lutezio (Z=71); questo periodo, che è costituito da 32 elementi, 14 in più rispetto al precedente, termina con il radon (Z=86). Il settimo e ultimo livello è incompleto e, a partire dall’uranio (Z=92) è formato da elementi poco stabili (elementi transuranici) in quanto radioattivi.
Confrontando gli atomi degli elementi di un medesimo gruppo, risulta che essi hanno la stessa configurazione elettronica esterna, la quale ne determina le principali caratteristiche chimiche, prima tra tutte la valenza: così il calcio e lo stronzio, entrambi bivalenti e appartenenti al gruppo 2, hanno configurazione rispettivamente 3s2 e 4s2. Conseguenza del progressivo riempimento di un livello lungo un periodo è la variazione delle proprietà metalliche che, spiccate negli elementi del gruppo 1 (metalli alcalini), decrescono gradualmente fino ad arrivare al gruppo degli alogeni, tipicamente non metallico, e a quello dei gas nobili, il cui livello quantico esterno completo ne caratterizza la scarsa reattività. Inoltre, dalla struttura elettronica risulta che gli elementi di un medesimo gruppo hanno gli elettroni esterni posti su orbitali atomici progressivamente più lontani dal nucleo: di conseguenza, scendendo lungo un gruppo, gli elettroni esterni risultano sempre meno legati così da giustificare l’aumento delle proprietà metalliche: accade così che uno stesso gruppo, per es. quello dell’azoto, sia formato da elementi leggeri tipicamente non metallici (lo stesso azoto e il fosforo) ed elementi più pesanti aventi proprietà metalliche (bismuto). Risulta perciò che l’elemento stabile dotato delle più spiccate proprietà metalliche è il cesio, che si trova in basso a sinistra nel sistema periodico, mentre l’elemento con la maggiore elettroaffinità è il fluoro, che si trova in alto a destra.
Infine, il fatto che gli elementi di transizione differiscono tra loro solo per il progressivo riempimento degli orbitali d e f dei livelli quantici inferiori a quello principale esterno, rende conto della maggiore gradualità con cui per tali elementi variano le proprietà chimiche, cosicché, per es., gli elementi delle terre rare presentano tra loro una notevole somiglianza chimica.
Astrofisica
Abbondanza degli elementi
La determinazione delle abbondanze relative degli elementi chimici nell’Universo (cioè il rapporto tra il numero di atomi di un dato elemento e il numero di atomi di un particolare elemento preso come campione: viene espressa in percentuale rispetto all’idrogeno o in percentuale di milioni di atomi di silicio in una scala che ponga l’abbondanza del silicio pari a 106) si basa sullo studio della composizione della Terra, delle meteoriti, dei pianeti del sistema solare, dello spazio interplanetario, del Sole, delle comete, delle stelle della nostra galassia, dello spazio interstellare, delle altre galassie, dello spazio intergalattico. Da questo studio, fatte delle normalizzazioni e delle opportune correzioni per tenere conto dei processi secondari che hanno caso per caso alterato localmente la distribuzione degli elementi, l’Universo appare notevolmente uniforme per quanto riguarda la sua costituzione. Così, per es., le meteoriti hanno perduto, a causa del forte riscaldamento subito entrando nell’atmosfera terrestre, la maggior parte dei loro costituenti volatili e di ciò si può tenere conto, ma le proporzioni relative dei loro elementi più pesanti sono molto simili a quelle osservate nel Sole. Si sono trovate abbondanze molto simili a quelle del sistema solare anche nel gas interstellare che circonda le stelle di più recente formazione e nelle nebulose planetarie.
Sono state messe in evidenza due leggi d’importanza fondamentale riguardo all’abbondanza relativa degli elementi: la prima è che gli elementi a numero atomico pari sono più abbondanti di quelli a numero atomico dispari, e la seconda è che l’abbondanza degli elementi decresce con il crescere del numero atomico.
Genesi degli elementi
Le abbondanze osservate si spiegano con i processi nucleari che hanno avuto luogo nella fase ancora molto calda e densa dell’Universo poco dopo il big-bang (nucleosintesi cosmologica) e successivamente nelle stelle (nucleosintesi stellare). La nucleosintesi cosmologica, il cui studio è stato sviluppato da R.A. Alphen, H. Bethe e G. Gamow (teoria α-β-γ) nel 1948, è essenzialmente responsabile della formazione di nuclidi molto leggeri (2H, 3He, 4He, 7Li). La nucleosintesi stellare, al cui studio hanno dato nel 1957 contributi fondamentali E.M. Burbidge, G.R. Burbidge, W.A. Fowler, F. Hoyle (teoria BBFH) e indipendentemente A.G.W. Cameron, ha luogo in una fase molto più avanzata, rispetto alla precedente, dell’evoluzione dell’Universo attraverso diversi processi.
Nucleosintesi cosmologica
I protoni (cioè i nuclei di idrogeno) e i neutroni si sono formati 10–6 s dopo il big-bang, quando a causa del parziale raffreddamento della sfera primordiale costituita da quark e gluoni, quark di colore diverso hanno cominciato a legarsi tramite gluoni tra loro, in terzetti stabili, i nucleoni, aventi carica di colore totale nulla. I nuclei di elio si sono formati circa quattro minuti dopo il big-bang: i protoni e i neutroni potevano infatti a questo punto, a causa dell’ulteriore diminuzione della temperatura (~ 109 K) dell’Universo in rapida espansione, legarsi insieme per formare nuclei di deuterio; i nuclei di deuterio fondendosi con un protone hanno dato luogo a nuclei di 3He, e quelli di 3He unendosi a un neutrone hanno formato nuclei di 4He, i nuclei leggeri più stabili. In precedenza tutto ciò non era possibile per la presenza in gran numero di fotoni di alta energia (più di un miliardo per ogni nucleone) e a causa della troppo elevata densità (che rendeva estremamente probabili processi di collisione) e temperatura dell’Universo (con conseguenti energie cinetiche molto grandi dei suoi costituenti). Sulla base della vita media del neutrone (che come è noto decade in un protone, un elettrone e un antineutrino) è possibile calcolare la percentuale di neutroni, inizialmente presenti praticamente in ugual numero dei protoni, sopravvissuti dopo circa quattro minuti dal big-bang, e quindi la frazione dell’elio rispetto all’idrogeno che risulta pari a 0,24. Dopo questa fase di formazione dell’elio l’Universo era troppo freddo per dare luogo alla nucleosintesi dei nuclei di elio in nuclei più pesanti e quindi per un lunghissimo intervallo di tempo la composizione dell’Universo è rimasta costante.
Nucleosintesi stellare
La formazione della maggior parte degli elementi ha avuto, e ha tuttora, luogo nelle stelle. Da queste, attraverso eventi catastrofici, che caratterizzano certe fasi della loro evoluzione (per es., esplosioni di supernova), gli elementi prodotti passano nello spazio interstellare. D’altra parte, alcuni processi di nucleosintesi avvengono proprio, in tempi brevissimi, durante tali eventi esplosivi (si parla, in questo caso, di nucleosintesi esplosiva). A eventi esplosivi, verificatisi in stelle di prima generazione oggi scomparse, si attribuisce il fatto che il materiale dal quale hanno tratto origine le stelle attuali fosse già arricchito di elementi pesanti, rispetto a quello scaturito dalla nucleosintesi cosmologica. Le reazioni di fusione nucleare, che avvengono nelle stelle, dipendono dalla loro composizione chimica iniziale, dalla massa e dalla fase evolutiva in cui esse si trovano. Nella fase di sequenza principale, il processo fondamentale è la fusione dell’idrogeno in elio, che avviene soprattutto attraverso il ciclo protone-protone, nelle stelle con massa M⟨1,5 M⊙ (con M⊙ = massa solare), e attraverso il ciclo CNO, nelle stelle più massive. Nelle fasi di vita successive, se la stella ha massa sufficientemente grande, si innescano: il processo 3α (cioè la fusione di tre nuclei di elio in 12C) e, in seguito, le combustioni del carbonio, dell’ossigeno e del silicio. Attraverso questi processi, si generano elementi via via più pesanti, fino al 56Fe. D’altra parte, la stella si impoverisce di certi elementi leggeri (Li, Be, B, D, 3He), che vanno distrutti. Gli altri processi rilevanti di nucleosintesi sono: a) il processo-α, che consiste nella cattura di una particella α da parte, per es., di 16O o 20Ne; b) il processo-e, che consiste in reazioni di fotodisintegrazione e ricombinazione, fra loro in equilibrio statistico; c) il processo-r (rapido) e il processo-s (lento), che consistono nella cattura di neutroni da parte di un nucleo. Tali processi giocano un ruolo essenziale nella produzione degli elementi più pesanti del ferro. Questi elementi, infatti, non possono essere generati in reazioni di fusione nucleare, che sarebbero fortemente endoenergetiche. Un neutrone, tuttavia, essendo privo di carica, può penetrare in un nucleo, senza essere respinto dalla forza coulombiana. La differenza fra il processo-r e il processo-s sta nel fatto che nel primo il tempo medio intercorrente fra due catture neutroniche successive è più breve della vita media del nucleo rispetto al decadimento β, mentre nel secondo accade l’opposto; il prevalere dell’uno o dell’altro processo dipende dalla intensità del flusso neutronico. d) Il processo-p, consistente nella cattura di un protone da parte di un nucleo. Come il processo-r, anche questo processo, che avverrebbe nelle esplosioni di supernova, contribuirebbe alla formazione di elementi pesanti. e) Il processo-χ, comprendente meccanismi diversi, come la spallazione (cioè la frammentazione) di nuclei da parte dei protoni dei raggi cosmici. Questo processo produce i nuclei leggeri ‘fragili’ (D, Li, Be, B).
Matematica
Il termine elemento ha spesso significato affine a infinitesimo (quantità variabile che tende al limite zero). In tal senso, elemento d’arco è un tratto infinitesimo di curva, più esattamente il differenziale dell’arco; analogamente si parla di elemento di superficie, di elemento di volume ecc.
In geometria differenziale, elemento lineare (per semplicità nel piano) è l’ente geometrico formato da un punto e da una direzione uscente da esso, insieme che può pensarsi complessivamente come un tratto brevissimo della retta avente la direzione data nell’intorno del punto dato.
Elemento di un insieme
Nella teoria degli insiemi, si dice che a è elemento dell’insieme I (o che a appartiene ad I) e si scrive a ∈ I, se e solo se a è un oggetto costituente l’insieme I. Per negare che a sia elementi di I si scrive a ∉ I, che si legge: a non è elemento di I, oppure a non appartiene ad I.