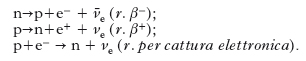radioattività
radioattività Emissione di radiazioni ionizzanti da parte di nuclei atomici (nuclei radioattivi) che subiscono una trasformazione strutturale.
Tipi di radioattività
La r. si distingue in r. naturale e r. indotta, o artificiale, a seconda che sia una proprietà spontanea dei nuclei o sia stata provocata per mezzo di qualche reazione nucleare. Un nucleo radioattivo, al momento stesso in cui manifesta la sua r. si trasforma, in genere, in un nucleo diverso; esso cioè decade, subendo un decadimento radioattivo. Il tipo delle radiazioni emesse consente di distinguere i seguenti 6 tipi di r. naturale o tipi di decadimento radioattivo, a ciascuno dei quali compete un certo modo di trasformarsi del nucleo originale, modi che nel complesso costituiscono le leggi dello spostamento radioattivo (con riferimento allo spostamento che, in un diagramma rappresentativo dei nuclidi, per es. in un diagramma con il numero di massa in ascissa e il numero atomico in ordinata, si dovrebbe generalmente fare per passare dal punto rappresentativo del nucleo originario a quello del nucleo risultante). Nella r. alfa il nucleo di numero di massa A e di numero atomico Z emette una particella α, cioè un nucleo di elio, 42He, e si trasforma in un nucleo di numero di massa A−4 e di numero atomico Z−2 (non varia A−2Z: fig. 1). Nella r. beta negativa il nucleo emette una particella β–, cioè un elettrone negativo, e si trasforma in un suo isobaro avente numero atomico Z+1. Nella r. beta positiva il nucleo emette una particella β+, cioè un positrone, e si trasforma in un suo isobaro avente numero atomico Z−1. Nella r. per cattura elettronica il nucleo cattura un elettrone dei livelli energetici più bassi, trasformandosi in un isobaro con numero atomico Z−1; l’avvenuta trasformazione nucleare si manifesta in questo caso per mezzo dei raggi X emessi nel riassestamento della struttura elettronica dell’atomo. Nella r. gamma il nucleo eccitato emette un raggio γ, ossia un fotone energetico, portandosi conseguentemente in un livello di energia minore. Nella r. per conversione interna il nucleo eccitato cede direttamente energia a un elettrone della struttura atomica, espellendolo. Negli ultimi due casi il nucleo finale ha lo stesso numero atomico Z e lo stesso numero di massa A del nucleo iniziale.
I nuclei possono decadere, oltre che per mezzo di questi 6 tipi di decadimento, anche tramite la fissione spontanea. In questo processo il nucleo si spezza in due frammenti (raramente più di due), approssimativamente di ugual massa. Solo i nuclei ad alto numero di massa danno origine a fissione; in effetti, processi misurabili di fissione spontanea sono stati osservati soltanto con riferimento agli elementi naturali più pesanti (Z>90 e A>230, o, più precisamente, Z2/A>45).
Nuclei pesanti (A=220-240) possono anche emettere spontaneamente nuclidi leggeri (quali carbonio, ossigeno, neon) ma con vite medie di svariati ordini di grandezza minori di quella del decadimento alfa (r. esotica, scoperta nel 1984).
Cenni storici
La scoperta della r. naturale, a opera di H. Becquerel nel 1896, fu conseguenza diretta della scoperta, da parte di W. Röntgen nel 1895, dei raggi X, che aveva provocato molte discussioni e molte ricerche sperimentali sull’origine della forte luminescenza che questi raggi inducono nel vetro delle ampolle in cui sono prodotti. Becquerel, sperimentando prima sul fosfato doppio di uranio e potassio, che è fosforescente, e poi su molti altri sali di uranio e sullo stesso uranio metallico, poté dimostrare che tutti i composti dell’uranio, fosforescenti o no, erano capaci di emettere ‘radiazioni attive’, capaci di impressionare le lastre fotografiche, che le radiazioni erano indebolite interponendo foglioline di alluminio o di rame tra la sorgente delle radiazioni e la lastra fotografica e infine che le radiazioni possedevano la proprietà di scaricare corpi elettricamente carichi. Due anni dopo le scoperte di Becquerel, Marie Skłodowska Curie, dapprima da sola poi con la collaborazione del marito Pierre Curie, intraprese la ricerca di eventuali nuove sostanze radioattive. Oltre alla scoperta che anche il torio è, come l’uranio, un elemento radioattivo (risultato raggiunto contemporaneamente e indipendentemente da G.C. Schmidt), M. Curie riuscì a dimostrare che la r. presentata da campioni contenenti uranio e torio era proporzionale alla quantità degli elementi presenti e indipendente da ogni cambiamento dello stato chimico e fisico dei campioni. Successivamente essa intraprese l’isolamento degli elementi chimici, fino a quel momento sconosciuti, responsabili del fatto che alcuni minerali di uranio presentavano una r. più alta di quella di cui poteva essere responsabile il solo uranio. Così, scoprì prima il polonio e poi il radio. E. Rutherford e F. Soddy scoprirono poi molti altri elementi radioattivi naturali. In particolare, Rutherford, studiando il potere di penetrazione delle radiazioni emesse dall’uranio, poté distinguere due tipi di radiazioni e cioè le particelle α, che possono essere completamente assorbiti da un foglio di carta, e i raggi β, più penetranti, che possono attraversare qualche millimetro di alluminio. Nel 1900, studiando sali di radio, P. Villard mise in luce un terzo tipo di radiazioni, i raggi γ, molto più penetranti.
I raggi β furono quelli studiati per primi; già nel 1899-1900 Becquerel e altri mostrarono che i raggi β sono deviati da campi magnetici ed elettrici in modo analogo ai raggi catodici, che essi hanno uno spettro continuo di energia, che la loro carica specifica è dello stesso ordine di grandezza di quella dei raggi catodici, con i quali, in definitiva, devono essere identificati. L’identificazione della natura dei raggi α fu più difficile e richiese un maggior numero di anni. Solo nel 1902 Rutherford riuscì, con campi elettrici e magnetici molto intensi, a deflettere i raggi α e trovò che, a parità di intensità di campo, la loro deflessione è minore e in verso opposto a quella dei raggi β. Negli anni successivi Rutherford, Soddy, W. Ramsey, H. Geiger e altri, dopo aver scartato una dopo l’altra differenti ipotesi, giunsero (1909) alla dimostrazione conclusiva che, qualunque sia la sostanza emettente, le particelle α sono da identificarsi con nuclei di elio e vengono emesse dai nuclei con uno spettro discreto di energia. La natura dei raggi γ fu identificata ancora più tardi, quantunque, già nel 1903, Becquerel avesse notato che essi hanno in comune con i raggi X la proprietà di non essere deviati da campi elettrici e magnetici. La natura elettromagnetica dei raggi γ fu riconosciuta soltanto nel 1912, con esperimenti di diffrazione su cristalli con il metodo di Laue, che permise anche, negli anni immediatamente successivi, la misurazione della loro lunghezza d’onda. Subito dopo la scoperta del nucleo atomico nel 1911, emerse in modo incontrovertibile che i fenomeni radioattivi hanno sede nel nucleo. Si concluse così, intorno al 1914, il periodo, iniziato da Becquerel nel 1896, in cui con una serie memorabile di esperimenti furono stabilite le proprietà e le leggi fondamentali della r. naturale.
Leggi del decadimento radioattivo
Un nucleo può decadere, cioè subire un processo di decadimento radioattivo, solo se il processo è energeticamente possibile. Tutti i nuclidi radioattivi, sia naturali sia artificiali, qualunque sia il tipo di decadimento che subiscono, obbediscono a una stessa legge di decadimento radioattivo, espressa dalla relazione:
dove N(0) è il numero di nuclei presenti all’istante t=0, N(t) il numero di quelli che non sono ancora decaduti all’istante t; λ è la costante di decadimento (o di disintegrazione) che ha il significato di probabilità di decadimento per un nucleo nell’unità di tempo (−dN/N=−λdt): il suo valore è una caratteristica del nuclide, è cioè uguale per tutti i nuclei della medesima specie, e non dipende dalla temperatura né dal legame chimico essendo una proprietà strettamente nucleare, indipendente anche dall’età del nucleo. La durata della vita effettiva di ogni singolo nucleo radioattivo può assumere ogni valore da 0 a ∞. La vita media τ di un gran numero di atomi della stessa specie è invece una quantità di valore ben definito e caratteristico per ogni nuclide in quanto è legata alla costante di decadimento λ dalla relazione:
Il numero di nuclei N(t) presenti in un campione radioattivo non è in genere facilmente misurabile; quello che si può misurare molto bene è il numero di disintegrazioni A che avvengono nell’unità di tempo, cioè l’attività, che anch’essa va decadendo nel tempo:
L’attività si dimezza in un intervallo di tempo T1/2 (detto tempo o periodo di dimezzamento o anche emivita) pari a τln2 =0,693τ.
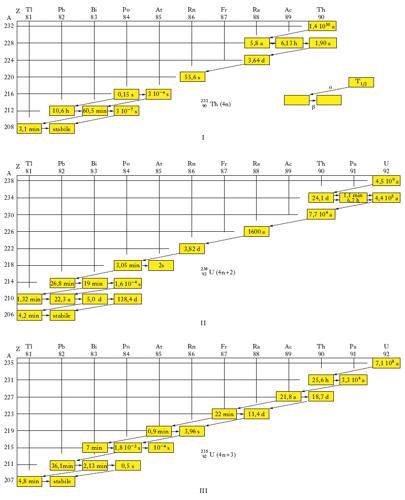
Decadimento alfa. Solo i nuclei degli elementi ad alto numero di massa (A≿200) danno luogo a decadimento alfa. Tutti i nuclidi che emettono particelle α possono essere classificati come appartenenti a una famiglia radioattiva. Come accennato prima, nel decadimento α il numero A di nucleoni diminuisce di 4, mentre gli altri possibili decadimenti (β−, γ ecc.) lasciano A inalterato. Le famiglie radioattive naturali sono 3 (fig. 1) e per ognuna di esse il numero di massa A è esprimibile con le seguenti formule (in cui n indica un numero intero): A=4n (famiglia del torio), A=4n+2 (famiglia dell’uranio-radio), A=4n+3 (famiglia dell’attinio-uranio). Esiste anche la famiglia del nettunio (A=4n+1) che comprende elementi artificiali. Tutti i radioelementi di una famiglia portano a un medesimo nucleo finale. Com’è noto, dalla misurazione del rapporto fra il numero di atomi del capostipite e il numero di atomi del prodotto finale stabile presenti nei minerali radioattivi si può dedurre, usando la precedente formula che governa l’equilibrio secolare, l’età della roccia in cui il minerale è contenuto (➔ datazione). Mentre i capostipiti delle tre famiglie naturali hanno vite medie dell’ordine di 109-1010 anni, quello della famiglia del nettunio ha una vita media di soli 2,2∙106 anni, molto breve rispetto alla vita della Terra, e ciò spiega perché questa famiglia non si trova in natura.
Decadimento beta. La r. β−, β+, e anche la cattura elettronica, trasforma un nucleo in un suo isobaro; il processo elementare consiste nella trasformazione di un protone del nucleo in un neutrone, o viceversa, con emissione di un elettrone (perché si conservi la carica totale) e di un neutrino (perché si conservino il momento angolare e il numero leptonico). Le transizioni possibili sono:
Solo la prima può avvenire con nucleoni liberi perché esoenergetica (si libera un’energia di 0,782 MeV). Nei nuclei il decadimento β− o β+ può avvenire solo quando la differenza di massa ΔM tra i due isobari è maggiore della massa me dell’elettrone; nella cattura elettronica è sufficiente che ΔM superi l’energia di legame Ee dell’elettrone da catturare.
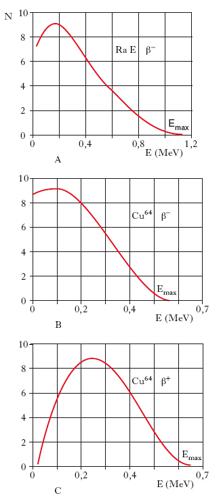
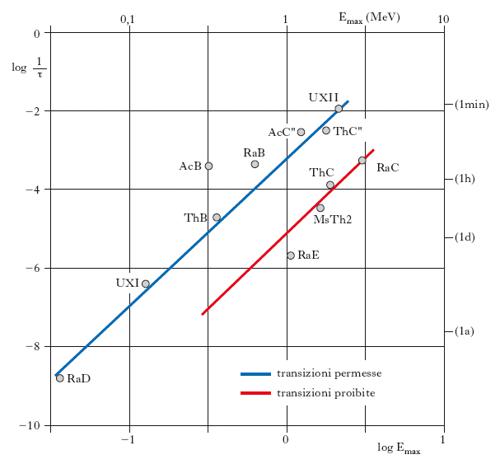
Lo spettro delle particelle β è continuo (fig. 2), in quanto l’energia disponibile, E, si deve ripartire fra tre particelle fino a una energia massima, Emax, caratteristica per ogni radionuclide, corrispondente praticamente all’energia di disintegrazione Ed. Gli spettri β+ (fig. 2C) si differenziano dai β− per l’assenza, a causa della repulsione elettrostatica, di particelle di energia nulla; gli spettri β− delle sostanze naturali sono di due tipi: quelli corrispondenti a transizioni permesse (è il caso della fig. 2B), più ricchi di particelle di bassa energia, e quelli corrispondenti a transizioni proibite (fig. 2A). Il concetto di transizioni permesse e proibite trae origine dalla correlazione empirica, fornita dai diagrammi di Sargent (fig. 3), tra energia massima, Emax, dello spettro e vita media τ. Per le famiglie radioattive naturali, le sostanze emettenti particelle β si dividono in due gruppi, in cui, a parità di Emax, quelli di un gruppo hanno vita media circa 100 volte maggiore di quelli dell’altro gruppo: questi ultimi corrispondono a transizioni permesse, mentre i primi corrispondono a transizioni proibite. Per i radionuclidi artificiali tale chiara suddivisione in due gruppi scompare, in quanto le transizioni proibite devono essere suddivise in ulteriori sottogruppi. La prima teoria quantitativa sulla forma degli spettri e sulla vita media dei nuclei radioattivi β fu elaborata da Fermi nel 1934, utilizzando l’ipotesi del neutrino avanzata poco prima da W. Pauli (➔ deboli, interazioni).
Decadimento per cattura elettronica. La r. di questo tipo potrebbe passare inosservata se non fosse accompagnata da alcuni fenomeni secondari. Infatti la cattura elettronica lascia l’atomo in uno stato di non equilibrio in quanto manca un elettrone in un livello più interno, che è stato catturato dal nucleo, mentre ce n’è uno di troppo in un livello esterno. Se l’elettrone catturato apparteneva, per es., all’anello K (cattura K), l’elettrone mancante potrà essere sostituito da uno dell’anello L, e così via finché tutto l’edificio elettronico si sarà riassestato. Negli elementi pesanti ognuna di queste transizioni elettroniche è accompagnata dall’emissione dei raggi X caratteristici dell’atomo, mentre negli elementi leggeri questi fotoni X hanno una elevata probabilità di essere assorbiti dall’atomo, che emette un elettrone della stessa energia del fotone assorbito (elettrone Auger).
Decadimento gamma. Uno stato eccitato di un nucleo avente un’energia che supera quella dello stato fondamentale di una quantità discreta Ed, può liberare questo eccesso di energia sotto forma di un fotone avente energia praticamente uguale a Ed. Per il principio di indeterminazione, quanto più breve è la vita media τ=1/λ di un livello eccitato, tanto meno determinata è l’energia del livello iniziale; indicando con Γ la larghezza dello stato eccitato si ha: Γτ≃h, con h costante di Planck. Emettendo un fotone γ, un nucleo può variare non solo la sua energia ma anche il suo momento angolare e la sua parità. Ciò ha portato a stabilire un certo numero di regole di selezione e di classificazione delle transizioni γ. Una prima teoria soddisfacente della vita media del decadimento γ è stata elaborata nel 1951 da V.F. Weisskopf.
Decadimento per conversione interna. La diseccitazione di un nucleo per emissione di un fotone γ è in concorrenza con il decadimento per conversione interna, che consiste nella cessione diretta dell’energia in eccesso del nucleo a un elettrone dell’atomo, che acquista l’energia Eβ=Ed−El. Gli elettroni emessi con maggiore probabilità sono quelli con maggiore energia di legame El e, a differenza di quelli emessi per r. β, sono monoenergetici. Il coefficiente di conversione interna, definito come il rapporto tra le transizioni che avvengono con questo processo e le transizioni γ, aumenta in genere, a parità di altre condizioni, all’aumentare del numero atomico Z. Il processo di conversione interna può aver luogo anche in casi nei quali l’emissione di un fotone γ è proibita (come, per es., nel caso di transizioni tra due stati del nucleo con momento angolare totale nullo e uguale parità). Anche la conversione interna, come la cattura elettronica, è accompagnata da raggi X caratteristici, dovuti al riassestamento dell’edificio elettronico, e anche da elettroni Auger. Quando Ed>2mec2 (con me massa a riposo dell’elettrone) si può anche avere la creazione interna di una coppia e+ e– in luogo dell’emissione di un fotone γ.
R. indotta
L’attivazione di una sostanza è basata su reazioni nucleari, ottenute per irradiazione (bombardamento con particelle massive o con fotoni); il nuovo nucleo talvolta può essere un isotopo di quello di partenza, ma molto spesso è invece chimicamente del tutto differente. Il nucleo formatosi per mezzo di queste reazioni può essere stabile o instabile; in quest’ultimo caso subisce decadimento radioattivo. Nella r. indotta i fenomeni che intervengono sono perciò due: la reazione nucleare e il decadimento radioattivo, che ubbidisce alle stesse leggi prima enunciate per la r. naturale.
Le seguenti reazioni nucleari possono servire a produrre nuclei radioattivi: a) reazioni provocate da neutroni termici o lenti (fino a energie di 0,02 eV); i neutroni, essendo privi di carica elettrica, possono reagire con i nuclei anche a energie così basse, dando origine in genere a reazioni (n, γ) o di cattura radiativa. In alcuni nuclei molto pesanti, i neutroni lenti possono provocare la fissione dalla quale si originano due o più frammenti radioattivi; b) reazioni di media energia (tra 5 e 50 MeV); in questo intervallo di energie anche le particelle cariche cominciano a poter superare la barriera di potenziale, almeno per nuclei abbastanza leggeri, e a poter provocare reazioni nucleari e, dati i valori dell’energia, possono eccitare il nucleo tanto che esso, nel diseccitarsi, può emettere uno o più nucleoni; c) reazioni di alta energia, le quali sono più complicate delle precedenti perché la particella incidente, qualunque essa sia, può trasmettere a diversi nucleoni del nucleo tanta energia da poter essi stessi urtare altri nucleoni, e così via, dando origine a una cascata intranucleare di nucleoni veloci. Di questi ultimi, alcuni possono uscire dal nucleo (nucleoni knock-on), mentre altri possono cedere la loro energia al nucleo residuo, che si diseccita poi con reazioni del tipo b). I prodotti di queste reazioni, detti prodotti di spallazione, sono, a parità di nucleo bersaglio, molto più vari di quelli prodotti con reazioni di media energia. Queste reazioni possono dare origine, nella diseccitazione del nucleo residuo, anche a processi di fissione di alta energia, i quali hanno caratteristiche in parte differenti da quelle della fissione provocata da neutroni di bassa energia ma che, comunque, determinano la formazione di frammenti radioattivi. Le particelle di alta energia possono provocare anche la fuoruscita di frammenti nucleari, radioattivi, con un processo diretto che si chiama reazione di frammentazione. Quando l’energia delle particelle incidenti è molto alta, per l’equivalenza massa-energia si possono creare, nell’urto, nuove particelle (pioni, kaoni ecc.); le particelle create possono contribuire a loro volta alla cascata intranucleare e almeno alcune di esse possono essere riassorbite dal nucleo, aumentando grandemente il numero dei possibili prodotti della reazione; d) reazioni indotte da deutoni e nuclei pesanti; tipiche di questa categoria sono le reazioni di stripping e di pick-up (➔ reazione), che avvengono anche a energie inferiori a quella della barriera coulombiana; a energia maggiore, entrano in gioco altri complessi meccanismi, che portano alla formazione di svariati tipi di nuclei residui; tra questi possono trovarsi anche elementi transuranici; e) reazioni foto- ed elettronucleari, cioè reazioni provocate da fotoni γ e da elettroni di alta energia.
Le sorgenti artificiali di attivazione, attualmente sempre più numerose, sono state, in ordine di tempo, gli acceleratori di particelle, che forniscono flussi elevati di protoni, elettroni, ioni e fotoni γ, e i reattori nucleari, che hanno permesso la produzione di grandi quantità di radioisotopi per mezzo di fasci di neutroni con spettro continuo di energia fino a circa 15 MeV e di intensità estremamente elevata. Infine, come causa di r. indotta sono da ricordare anche le esplosioni nucleari, che riversano nell’ambiente, in genere nell’aria, neutroni e frammenti di fissione.
La quantità Nx di un determinato radioisotopo formatosi in uno dei modi anzidetti e la sua attività Ax=λxNx dipendono dal tempo di irradiazione ti, dal flusso Φ di particelle incidenti sulla sostanza irradiata, dal numero nT di nuclei bersaglio per grammo di sostanza, dalla costante di decadimento λx del radioelemento in questione, dalla sezione d’urto σTx, dalla reazione nucleare di formazione e dal tempo te di raffreddamento, che intercorre tra la fine dell’irradiazione e la misurazione dell’attività:
I radioelementi possono a loro volta dare origine a serie di decadimenti radioattivi; l’attività dei prodotti di disintegrazione è data da relazioni molto più complicate della precedente, nota come formula di attivazione. Attualmente sono noti quasi 1000 radioelementi artificiali, la cui produzione su scala industriale viene fatta usando soprattutto le reazioni provocate dai fasci di neutroni dei reattori nucleari. Essi trovano numerose applicazioni nei più svariati campi (➔ radioisotopo).
R. ambientale
Elementi radioattivi di varia origine e natura sono presenti nell’ambiente terrestre, contenuti nelle principali componenti ambientali (acqua, aria, crosta terrestre, biosfera). Gli elementi radioattivi naturali sono contenuti nell’ambiente da tempi remoti e la loro presenza è principalmente regolata da processi legati alle caratteristiche geomorfologiche; viceversa quelli artificiali sono stati immessi dalle varie attività umane (in larga misura dalle esplosioni nucleari sperimentali nell’atmosfera degli anni 1950 e dei primi anni 1960). Lo studio dei livelli di r. ambientale consente la stima della dose di radiazioni assorbita dalla popolazione. La r. naturale in un sito è molto stabile anche per tempi molto lunghi; esistono aree (per es., in India e in Brasile) che a causa delle caratteristiche geomorfologiche presentano una concentrazione molto elevata di radionuclidi naturali nella crosta terrestre; in Italia, il Lazio e la Campania presentano le aree con i maggiori livelli di r. naturale. Oltre alla radiazione cosmica, le radiazioni naturali che causano l’esposizione esterna dell’uomo sono raggi di varia energia di origine terrestre emessi principalmente da: 40K, 238U e i suoi discendenti (famiglia dell’uranio); 232Th e i suoi discendenti (famiglia del torio). Proprio una concentrazione particolarmente elevata di radionuclidi delle famiglie dell’uranio e del torio è presente nei tufi vulcanici del Lazio e della Campania. A livello del mare, e in aree con concentrazione normale di radionuclidi naturali, l’esposizione esterna è per il 40% dovuta alla radiazione cosmica e per il restante 60% alla r. terrestre. La dose assorbita a causa di radionuclidi naturali che penetrano nel corpo umano (attraverso l’aria, l’acqua, i cibi) e si depositano nei tessuti, la cui stima è più complessa, è per alcuni organi (come, per es., i polmoni) di poco superiore a quella dovuta all’esposizione naturale esterna. La r. artificiale è in media molto minore di quella naturale, eccezion fatta per alcuni siti particolari (per es., in prossimità di impianti nucleari) e per alcuni eventi straordinari (per es., incidenti in centrali elettronucleari; ➔ radiocontaminazione).