atmosfera
Fisica
Involucro gassoso che circonda o sovrasta un corpo solido o liquido; in particolare quello che circonda la Terra (a. terrestre) e altri pianeti (a. planetarie). Talora si parla di a. anche per il Sole e per le stelle, che sono corpi completamente gassosi: in tal caso s’intendono per a. gli strati più esterni e meno densi. La massa dell’a. terrestre è un milionesimo di quella della Terra; il 99% si trova al di sotto di 50 km di quota e il 90% al di sotto di 17 km.
L’a. terrestre primitiva
Le teorie sulla formazione del sistema solare avvalorano l’ipotesi di un’a. terrestre primitiva formatasi successivamente alla nascita del pianeta. Mentre il Sole si andava formando per collasso gravitazionale del centro della nebula originaria, dove la temperatura raggiungeva milioni di kelvin, nelle zone periferiche della nube di gas si formavano i pianeti, anch’essi per accrescimento gravitazionale. Il processo di accrescimento dei pianeti, pur avvenendo a temperature inferiori rispetto a quello della stella, comportava comunque la fusione della materia che cadeva sulla superficie, facendo così liberare i gas contenuti nelle particelle di pulviscolo della nube. Il miscuglio di gas che costituì l’a. doveva provenire essenzialmente dai composti volatili contenuti nel materiale catturato. La composizione chimica dell’a. iniziale rimane oggetto di discussione. Si concorda però sul fatto che in un ambiente riducente per eccesso di idrogeno le forme più stabili in cui si potevano trovare il carbonio, l’azoto e l’ossigeno erano il metano, l’ammoniaca e il vapor d’acqua.
Magnetosfera
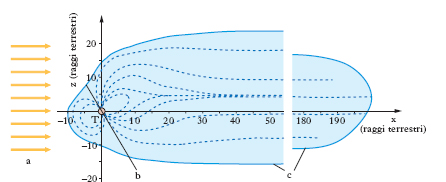
La precisazione della forma e delle dimensioni dell’a. è essenzialmente relativa alla definizione del limite superiore dell’a., oltre il quale l’a. medesima sfuma nel circostante spazio interplanetario (fig. 1). Il limite dell’a. fu definito agli inizi del Novecento come la quota massima alla quale le molecole possono risentire dell’azione della Terra e posto alla quota di circa 2500 km, là dove l’energia potenziale gravitazionale terrestre cessa di prevalere sull’energia cinetica di agitazione termica delle molecole atmosferiche. Tuttavia studi successivi misero in evidenza come a queste alte quote, e a quote maggiori, le molecole atmosferiche fossero in larga parte ionizzate e quindi soggette all’azione del campo magnetico terrestre: il limite superiore dell’a. fu pertanto spostato alla magnetopausa, là dove il campo magnetico terrestre sfuma nel circostante campo magnetico interplanetario. L’alta a. fu da quel momento fatta coincidere con la magnetosfera. Quest’ultima non ha una forma simmetrica rispetto all’asse del campo magnetico terrestre; infatti, in alta quota, il campo magnetico terrestre è deformato a causa delle interazioni con i flussi di particelle cariche veloci emesse dal Sole (vento solare): alla magnetosfera e conseguentemente all’alta a. viene oggi attribuita una forma che ricorda grosso modo quella di una cometa caudata, con dimensioni di circa 10 per 200 raggi terrestri, cioè di circa 64.000 km per 1,3∙106 km.
Suddivisione in zone
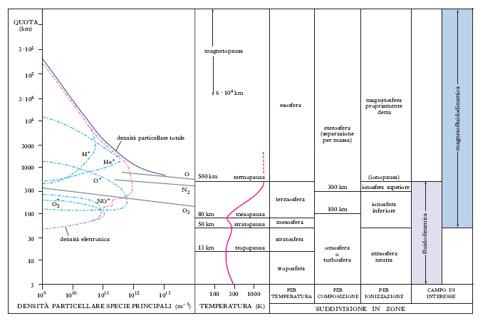
Nella suddivisione in zone dell’a. terrestre, il criterio più seguito e più largamente diffuso, in quanto è adottato dal 1951 dall’Unione internazionale di geodesia e geofisica, fa riferimento all’andamento della temperatura con la quota (fig. 2). La troposfera, nella quale la temperatura decresce con la quota al tasso medio di 6,5 °C/km, si estende dal suolo sino a una certa quota, detta tropopausa, variabile da circa 10 km, ai poli, a circa 17 km, all’equatore (oltre che con la latitudine, vi è anche una variazione stagionale: la troposfera, infatti, è più spessa d’estate che d’inverno). Nella stratosfera, la temperatura cresce con la quota, passando da circa −55 °C, alla tropopausa, a circa 0 °C, a una quota di circa 50 km, detta stratopausa. Nella mesosfera la temperatura torna a decrescere con la quota; il valore minimo, che è il minimo assoluto delle temperature atmosferiche, è di circa −83 °C e viene raggiunto a una quota di circa 85 km, detta mesopausa e costituente il limite superiore della zona. Nella termosfera la temperatura cresce con la quota, sino a raggiungere un valore massimo di circa 1500 °C (naturalmente, inteso come temperatura cinetica) alla quota di 400-500 km, che costituisce il limite superiore della zona ed è detta termopausa. L’ esosfera, nella quale la temperatura resta costante intorno ai 1500 °C, si estende dalla termopausa al limite esterno dell’atmosfera.
Seguendo un diverso punto di vista, quello della composizione chimico-fisica, è abituale chiamare omosfera la zona, estendentesi sino a circa 80 km dal suolo, in cui la composizione chimica non varia, ed eterosfera la parte sovrastante, in cui la composizione è determinata dall’equilibrio locale tra numerosi processi concomitanti (dissociazione delle molecole in atomi, diffusione, ionizzazione, ricombinazione ecc.); la quota di separazione tra omosfera ed eterosfera coincide all’incirca con la mesopausa e viene detta omopausa.
Si parla poi di ionosfera per indicare la parte dell’a. da circa 60 km di quota in su, in cui è alta la densità di ioni ed elettroni liberi.
Condizioni fisiche
I gas atmosferici ubbidiscono abbastanza bene all’equazione di stato p=(RρT)/M, dove p è la pressione, R la costante dei gas perfetti, ρ la densità, T la temperatura termodinamica, M il peso molecolare medio; p e ρ sono poi legate dall’equazione (dp/dh)=−gρ con h quota e g accelerazione di gravità. Rispetto alle caratteristiche elettriche e ottiche l’a. si presenta come un mezzo fortemente anisotropo, sede di interessanti e, talora, vistosi fenomeni: il campo elettrico terrestre, la rifrazione ionosferica delle radioonde, la rifrazione atmosferica della luce, le aurore polari, gli arcobaleni, gli aloni, la scintillazione delle stelle ecc. Estremamente interessanti sono anche i fenomeni di assorbimento della radiazione solare e cosmica. Per quanto riguarda infine la dinamica dell’a., si deve ricordare l’esistenza delle correnti a getto, fluenti con elevata velocità al livello della tropopausa, nonché la presenza di moti regolari (tra questi, le cosiddette maree atmosferiche) e di venti con elevata intensità (velocità di centinaia di km/h a quote di 100-300 km).
Composizione e chimica dell’atmosfera
Omosfera ed eterosfera
Nella zona della omosfera, sino a circa 80 km di quota, la composizione dell’a. è pressoché costante, non molto diversa da quella dell’aria secca e pulita al suolo, quale è riportata nella tabella (si noti come l’azoto e l’ossigeno costituiscano, da soli, il 99% dell’a.). Le maggiori differenze, a parte i componenti minori, si hanno nel contenuto di argo, neo ed elio, e in quello di ozono, che risulta massimo nella cosiddetta ozonosfera: differenze dovute per un verso a diffusione dall’alto verso il basso dei gas nobili, per l’altro a fotodissociazione di ossigeno molecolare e conseguente formazione di O3. Nella eterosfera, a quote maggiori di circa 80 km, divengono sempre più importanti i fenomeni di fotodissociazione e di fotoionizzazione. Alle quote delle aurore polari (100-500 km) i componenti accertati sono l’ossigeno molecolare e atomico, l’azoto molecolare e infine il sodio, oltre ad alcuni radicali liberi (per es., −OH) e, naturalmente, a ioni ed elettroni liberi; a quote ancora maggiori la ionizzazione è totale, sino ad arrivare, ai confini dell’a., a un plasma essenzialmente costituito da protoni ed elettroni.
Troposfera
Nella troposfera è presente un elevato numero di composti chimici di origine antropica e naturale emessi a livello della superficie terrestre. Il radicale •OH, che è il principale agente ossidante di quasi tutti i composti della troposfera e in particolare dei composti organici, è il componente più importante. Ogni composto anche moderatamente reattivo per azione di tale radicale viene eliminato e non ha un tempo di vita sufficientemente lungo per essere trasportato nelle zone superiori dell’atmosfera.
In condizioni naturali la chimica della troposfera è governata dal metano e dagli ossidi d’azoto, NO e NO2. L’ozono, O3, in parte prodotto nella stratosfera come risultato della fotolisi di O2 e trasportato in basso, in parte generato in situ per via chimica dall’ossidazione del metano, reagisce con NO per formare NO2, che, a sua volta, subisce una rapida fotolisi durante le ore diurne:
NO2+hv → NO+O
dove hv indica un fotone. A questa reazione fa seguito, con velocità molto elevata quella di formazione dell’ozono. Il principale processo di eliminazione di NOx durante le ore diurne è la reazione di NO2 con il radicale •OH per formare acido nitrico. A causa della complessa distribuzione geografica delle loro fonti, la distribuzione spaziale degli NOx è molto variabile. Il loro tempo di vita nella troposfera è breve, variando da meno di 1 giorno in prossimità della superficie terrestre a 1 settimana circa nella tropopausa.
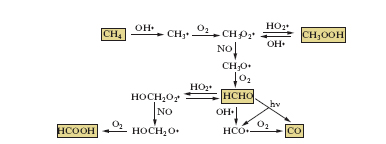
Il metano (CH4), che è l’idrocarburo più abbondante dell’a., emesso da fonti sia naturali sia antropiche, viene eliminato dall’a. prevalentemente dalla reazione:
CH4 •OH → CH3+H2O
Il radicale CH3• reagisce esclusivamente con O2 producendo il radicale metilperossido (CH3O2), che a sua volta può reagire con gli ossidi d’azoto, l’idroperossido (HO2) e altri radicali perossidi. Un sistema complesso di reazioni porta alla formazione di ossido di carbonio, formaldeide e acidi organici, come illustrato nello schema della fig. 3. La formaldeide, un importante gas presente in tracce nella troposfera, può essere soggetta a sua volta a fotolisi per formare CO e HCO. Il passo conclusivo nella catena di ossidazione del metano è l’ossidazione del CO per reazione con il radicale •OH:
CO+•OH → CO2+H.
L’ossidazione dei composti gassosi contenenti zolfo con formazione di particelle di solfati è una fonte importantissima di nuclei di condensazione di vapore e può influenzare direttamente il bilancio della radiazione terrestre attraverso la dispersione della radiazione solare a basse lunghezze d’onda. Nelle regioni industrializzate l’acido solforico che deriva da fonti antropiche di diossido di zolfo (SO2) è una delle cause principali dell’acidità delle piogge.
Stratosfera
Nella stratosfera, il componente chimico qualitativamente più importante è l’ozono (➔) anche se la quantità presente è estremamente piccola poiché, a un’altitudine compresa tra i 25 e i 30 km, raggiunge una concentrazione massima 10/20 volte maggiore di quella al suolo, pari a 10 parti per milione (ppm) in volume. La formazione dell’ozono ha luogo nella stratosfera a un’altitudine superiore ai 30 km circa, dove le radiazioni solari ultraviolette con lunghezze d’onda inferiori ai 242 nm dissociano lentamente l’ossigeno molecolare:
O2 + hv → O + O
L’atomo d’ossigeno reagisce rapidamente con l’ossigeno molecolare in presenza di una terza molecola (solitamente un altro O2 o N2) formando ozono:
O + O2 + M → O3 + M
L’O3 assorbe fortemente le radiazioni con lunghezze d’onda comprese tra i 240 e i 320 nm per decomporsi di nuovo in O2 e O. Inoltre l’ozono può reagire con l’ossigeno atomico per generare nuovamente due molecole di O2. Questo meccanismo per la produzione dell’ozono nella stratosfera è stato proposto nel 1930 dal meteorologo inglese S. Chapman.
L’ozono viene distrutto nella stratosfera attraverso una serie di cicli catalitici, costituiti da catene di reazioni le quali rigenerano la molecola che inizialmente reagisce con O3. Sono state identificate tre famiglie chimiche che coinvolgono idrogeno e azoto atomici e cloro, e che attraverso cicli catalitici contribuiscono a distruggere parte dell’ozono prodotto nelle reazioni di Chapman. Nel 1974 M.J. Molina e F.S. Rowland scoprirono che la classe di molecole dette clorofluorocarburi (➔), prodotti e utilizzati dall’uomo in diverse applicazioni tecnologiche, non vengono distrutti nella troposfera ma sopravvivono nell’a. fino a diffondersi nei suoi strati più elevati dove la potente luce ultravioletta li fotolizza. Le reazioni di fotolisi rilasciano un atomo di cloro (Cl), estremamente reattivo nei confronti dell’O3 che innesca un rapido ciclo di distruzione dell’O3 coinvolgendo un radicale molto reattivo, il monossido di cloro (ClO•):
Cl + O3 → ClO•+ O2
ClO•+ O → Cl•+ O2
con reazione complessiva
O3 + O → O2 + O2•
Apparentemente i cicli descritti dovrebbero portare alla distruzione definitiva dell’O3. In realtà il ciclo si interrompe quando le specie reattive •OH, NO2, Cl e ClO vengono coinvolte in altre reazioni.
Le reazioni descritte hanno massima efficienza alle medie latitudini terrestri e particolarmente ai tropici, dove la luce ultravioletta è più abbondante, l’ossigeno atomico è più facilmente disponibile e vi è una continua formazione di ozono.
Metrologia
Unità pratica di misura della pressione (simbolo atm), pari alla pressione atmosferica media a livello del mare: è la pressione esercitata da una colonna di mercurio alta 760 mm a 0 °C, ed equivale a 101.325 Pa; detta più specificamente a. fisica, si distingue dall’a. tecnica (simbolo at), che è la pressione esercitata dalla forza peso di 1 kg sulla superficie di 1 cm2 (98.066,5 Pa).
Tecnica
A. standard
Ambiente ideale, i cui parametri fisici sono stati stabiliti dall’ICAO (➔), utilizzato nell’ambito delle scienze aerospaziali per valutare e stabilire caratteristiche prestazionali di velivoli e altre apparecchiature in condizioni standardizzate. I valori delle grandezze che caratterizzano l’a. sono i seguenti:
a) latitudine 45°;
b) aria secca (umidità relativa: 0%) e priva di impurità;
c) pressione atmosferica al livello medio del mare: 1 atm=101.325 Pa;
d) temperatura al livello medio del mare: 15 °C;
e) densità dell’aria al livello medio del mare: 1,225 kg/m3;
f) gradiente barico verticale: −1 hPa ogni 9 m di altitudine;
g) gradiente termico verticale: −6,5 °C ogni 1000 m di altitudine fino a 11.000 m, nullo da 11.000 a 20.000 m, irregolare oltre i 20.000 m.