ozono
Forma allotropica dell’ossigeno, simbolo O3, peso molecolare 48; gas di colore bluastro, di odore caratteristico pungente; a temperatura ordinaria si decompone molto lentamente in ossigeno, ma la velocità di decomposizione aumenta rapidamente con la temperatura e, al di sopra di 400 °C, la trasformazione avviene istantaneamente, anche con esplosioni. La sua solubilità in acqua (490 ml/l a 0 °C) è maggiore di quella dell’ossigeno; in soluzioni acquose di acido solforico e in quelle di sali neutri è molto meno solubile che in acqua, mentre è solubile in cloroformio, in tetracloruro di carbonio, in acido acetico, in anidride acetica e in acido propionico. L’o. è un energico ossidante e in aria umida attacca tutti i metalli a eccezione del platino e dell’oro. Reagisce con i composti organici contenenti doppi o tripli legami addizionando i 3 atomi di ossigeno al legame non saturo con formazione di ozonuri. I gruppi −SH,=S, −NH2,=NH,−OH (fenolico) e −CHO dei composti organici sono facilmente ossidati dall’o., mentre non vengono quasi affatto attaccati gli idrocarburi saturi.
Formazione e preparazione dell’ozono
Piccole quantità di o. si formano insieme all’ossigeno nella decomposizione termica dei persolfati e per riscaldamento di una miscela di perossido di bario o di permanganato di potassio con acido solforico. In quantità maggiore si ottiene nella elettrolisi degli acidi solforico e perclorico. Per applicazioni che richiedono piccole quantità di o. e in modesta concentrazione si ricorre al metodo di preparazione per via fotochimica, sottoponendo l’aria o l’ossigeno all’azione di radiazione U.V. di lunghezza d’onda inferiore a 2200 Å.
Per tutte le altre applicazioni industriali o di laboratorio, per ottenere quantità più elevate e concentrazioni maggiori, l’o. viene preparato mediante ozonizzatori, che trasformano l’ossigeno in o. tramite scariche elettriche sull’aria o sull’ossigeno puro; si ricorre al sistema dell’effluvio elettrico, o scarica oscura, ottenuta facendo passare aria fra due elettrodi, fra i quali si mantiene un’elevata differenza di potenziale; gli elettroni che si liberano vanno a colpire le molecole d’ossigeno dissociandole negli atomi, che reagendo con altre molecole indissociate formano l’o.; se si usa corrente continua, gli elettroni si scaricano all’elettrodo con scarsa probabilità di urtare le molecole di ossigeno; usando invece una corrente alternata, gli elettroni sono costretti a invertire la propria direzione alternativamente verso l’uno o l’altro elettrodo, in accordo con la frequenza della corrente; la maggiore permanenza nella zona di scarica accresce la probabilità degli urti e quindi la formazione di ozono.
L’energia degli elettroni, e quindi l’efficacia del sistema, aumenta con la differenza di potenziale, ma poiché al crescere di questa, data la piccola distanza che si deve tenere fra gli elettrodi, si avrebbero elevati riscaldamenti (che favoriscono la decomposizione dell’ozono in ossigeno), si preferisce innalzare la frequenza della corrente (anche fino a 500-1000 Hz) mantenendo più bassa la tensione. Ciò consente di realizzare apparecchi di minore ingombro ma di maggiori produzioni. Così, aumentando la frequenza da 50 a 600 Hz, si possono costruire ozonizzatori capaci di produrre 20 kg/h di o. con un ingombro che si riduce da 13,6 a 3 m2, sempre mantenendo una tensione di 14 kV.
Gli ozonizzatori possono essere di tipo a piastre o a tubi orizzontali. I primi sono formati da casse di alluminio, nelle quali sono disposte, verticalmente e a coppie, le piastre di vetro fissate a breve distanza l’una dall’altra, con la superficie esterna rivestita di materiale conduttore (stagnola, vernice conduttrice) a formare un elettrodo; l’aria attraversa lo spazio entro le coppie di lastre di vetro e all’interno della cassa, collegata a terra, circola acqua di raffreddamento. Nel tipo a tubi orizzontali, in acciaio inossidabile, questi sono collegati a terra formando il primo elettrodo e portano all’interno, disposto coassialmente, un tubo di vetro, la cui parete interna è conduttrice, costituendo l’altro elettrodo; l’aria viene fatta passare attraverso l’intercapedine tra il tubo di acciaio e quello di vetro; attorno ai tubi metallici circola acqua di raffreddamento. La produzione degli ozonizzatori nei migliori dei casi è dell’ordine di 150 g/kWh. L’o., comunque ottenuto, va purificato mediante distillazione frazionata dell’ossigeno ozonizzato liquido, sfruttando la minor volatilità dell’o. rispetto all’ossigeno; si ottiene così o. puro al 99% circa.
Proprietà e impiego
L’o. ha proprietà disinfettanti e battericide, deodoranti, decoloranti. L’impiego industriale più importante dell’o. è nella sterilizzazione e deodorizzazione dell’acqua potabile e delle acque per piscina; è inoltre usato come ossidante in diverse sintesi organiche: preparazione del cortisone e di altri ormoni, fabbricazione dell’aldeide anisica dall’anetolo, della vanillina dall’isoeugenolo, del piperonalio dall’isosafrolo; come antibatterico in concentrazione di 1-3 ppm per la conservazione di alimenti; nella sbianca delle cere, di oli, della carta, dello zucchero ecc.; per invecchiare artificialmente il legno, il vino, i liquori; nella preparazione di profumi e sostanze coloranti ecc.
La somministrazione terapeutica di ossigeno ozonizzato al fine di migliorare l’ossigenazione del sangue (ozonoterapia) è stata applicata in passato a numerose condizioni morbose (coliti croniche, scompenso cardiaco, arteriti periferiche, stasi venosa agli arti inferiori, ernie ecc.), ma non ha avuto molta diffusione.
Concentrazione
L’o. è contenuto nell’aria in piccole quantità; al suolo la sua concentrazione media è di 0,02 parti per milione, mentre nella stratosfera raggiunge valori anche 10 volte superiori. La concentrazione dell’o. nella stratosfera è il risultato di un bilancio fra processi di produzione e processi di distruzione. L’o. viene prodotto nella stratosfera tramite dissociazione, per opera della radiazione ultravioletta solare, dell’ossigeno molecolare in ossigeno atomico e successiva combinazione fra ossigeno molecolare e ossigeno atomico a formare o. attraverso le reazioni:
[1] O2 + hν → O + O
[2] O + O2 + M → O3 + M
dove hν è l’energia di un fotone ultravioletto e M una qualsiasi molecola dei gas atmosferici, che deve partecipare alla collisione affinché siano soddisfatte le leggi di conservazione dell’energia e della quantità di moto. Il processo è più efficiente ad alta quota (dove l’intensità della radiazione ultravioletta non è stata attenuata dall’assorbimento atmosferico) e alle basse latitudini (dove il Sole è più alto nel cielo). Pertanto, la massima produzione di o. si ha nell’alta stratosfera delle regioni tropicali. Contestualmente alla produzione di o. coesiste un processo di distruzione provocato dalla radiazione ultravioletta (e in misura assai minore da quella visibile) che dissocia le molecole di o.:
[3] O3 + hν → O + O2.
L’ossigeno atomico che così si forma può poi reagire con altro o. formando O2:
[4] O + O3 → O2 + O2.
La [3] è molto importante perché conduce all’assorbimento dei raggi ultravioletti, la cui energia si trasforma in energia termica dell’atmosfera. D’altra parte, se l’o. fosse distrutto soltanto attraverso le reazioni [3] e [4], la sua abbondanza nella stratosfera sarebbe assai maggiore di quella che è nella realtà. Infatti, la maggior parte dell’ossigeno atomico, che si sviluppa nella [3], non partecipa alla [4], ma si ricombina con l’O2 attraverso la [2], rigenerando l’ozono. In effetti, la distruzione dell’o. è provocata anche da processi catalitici dovuti alla presenza di sostanze che funzionano appunto da catalizzatori per questa reazione.
Esiste uno stretto legame fra la presenza dell’o. nella stratosfera e l’inversione dell’andamento della temperatura che ivi si verifica, dovuta all’assorbimento della radiazione ultravioletta solare da parte dell’ozono. L’ozonosfera, la regione della stratosfera (dello spessore di circa una ventina di kilometri) dove è maggiormente concentrato l’o., svolge una funzione importantissima per la biosfera. Infatti, la radiazione ultravioletta, che l’o. assorbe, è estremamente nociva per gli esseri viventi perché altera il materiale genetico (DNA), cui è affidata la loro riproduzione; nell’uomo può inoltre provocare tumori della pelle e danni oculari (fotocheratiti, cheratopatie, cataratte ecc.).
La concentrazione dell’o. nell’atmosfera può essere misurata sia in situ (a bordo di aerei, palloni stratosferici, razzi ecc.), sia con tecniche di telerilevamento (da terra o da satellite). Le osservazioni del primo tipo sono le più convenienti per determinare, con elevata precisione, il profilo verticale dell’abbondanza dell’o.; quelle del secondo, d’altra parte, sono le uniche in grado di fornire la distribuzione dell’o. sull’intero pianeta. Tale distribuzione non dipende soltanto dai processi chimici attraverso cui l’o. viene prodotto e distrutto, ma anche dai fenomeni di trasporto causati dalla circolazione atmosferica.
A quote maggiori di 25-30 km, l’equilibrio dell’o. è determinato prevalentemente dai processi chimici, a quote inferiori dai processi dinamici: poiché la bassa stratosfera è la più ricca di o., sono questi ultimi a giocare il ruolo dominante. Infatti, la densità colonnare dell’o. è minima nella fascia equatoriale, dove la produzione di questo gas è massima, ma le correnti d’aria ascendenti tendono a disperderlo verso l’alto; essa è, invece, massima a latitudini elevate (60°), nelle aree di alta pressione, dove la produzione di o. è scarsa, ma le correnti d’aria discendenti tendono a concentrarlo verso il basso. Inoltre, la distribuzione non è simmetrica rispetto all’equatore: nell’emisfero settentrionale i livelli di o. sono più alti che in quello meridionale, mentre in entrambi gli emisferi si registrano notevoli variazioni anche con la longitudine.
A partire dall’inizio degli anni 1980, nei mesi di settembre-ottobre (primavera australe), è stato verificato sistematicamente un forte calo della densità colonnare dell’o. nell’atmosfera antartica. Il fenomeno ha continuato a presentarsi, e spesso con caratteristiche accentuate, negli anni successivi. I processi che conducono a questa distruzione stagionale dell’o. nell’atmosfera antartica (il cosiddetto buco dell’o.) sono controversi: è opinione largamente diffusa che sia la lieve diminuzione del contenuto globale di o. dell’atmosfera registrato, sia la progressiva accentuazione del buco primaverile dell’o. sull’Antartide siano imputabili anche a sostanze di origine antropica. Il ruolo principale sembra essere svolto dai clorofluorocarburi (in seguito ad accordi internazionali, non sono più utilizzati); anche se la quantità di cloro trasportata nell’atmosfera da tali composti può apparire trascurabile (essa è assai meno di 1/1000 di quella complessivamente immessa nell’atmosfera dai processi naturali); occorre rilevare tuttavia che i clorofluorocarburi si distinguono dalla maggior parte degli altri composti del cloro per la loro insolubilità in acqua (che impedisce che essi siano trascinati al suolo dalla pioggia) e per l’inerzia chimica (che li fa permanere inalterati nella troposfera per decenni). A causa di queste loro caratteristiche, le molecole dei clorofluorocarburi lentamente diffondono raggiungendo l’ozonosfera; ivi esse sono dissociate dalla radiazione solare e liberano il cloro, che dà origine a cicli di reazioni che portano alla distruzione dell’o.:
Tuttavia, nonostante la messa al bando dei clorofluorocarburi, data la loro estrema stabilità, si prevede che la concentrazione del cloro nella stratosfera continuerà ad aumentare per parecchi anni, ritornando ai livelli normali solo fra circa un secolo. È comunque difficile valutare gli effetti che questo aumento del cloro (e di altri agenti inquinanti come il bromo) potrà avere sull’ozonosfera.
Ozonuri
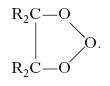
Gli ozonuri inorganici si ottengono facendo reagire gli idrossidi dei metalli alcalini, allo stato secco, con o. gassoso a temperature molto inferiori a quella ordinaria; hanno formula generale MeO3, dove Me è un metallo alcalino (per es., potassio, rubidio, cesio) e sono stabili. Sono composti a carattere ionico contraddistinti dalla presenza dell’anione O3–. Sono noti ozonuri organici che si ottengono per addizione dell’o. ai composti insaturi. La struttura degli ozonuri derivati dai composti etilenici è stata a lungo dibattuta, ma si ritiene che nella reazione si formi dapprima un ozonuro primario più instabile, per addizione elettrofila dell’o. (al quale è possibile attribuire forme ibride di risonanza di tipo ionico) al doppio legame:
Il prodotto così ottenuto si trasforma in seguito nell’ozonuro avente struttura
Questi ozonuri sono composti difficilmente isolabili, stabili soltanto a temperatura molto bassa, e che per riscaldamento possono dar luogo a esplosioni; sono dotati di azione sbiancante, germicida, catalitica nelle reazioni di polimerizzazione ecc. Si decompongono facilmente (per es., tramite idrolisi a caldo) dando luogo ad aldeidi, chetoni o acidi carbossilici a seconda dell’ambiente ossidante o riducente e della posizione del doppio legame. Nel caso di ozonuri derivati da composti contenenti legami acetilenici, si può non avere scissione completa del triplo legame; in tal caso si ha formazione di un dichetone.
L’ozonolisi è il processo di scissione ossidativa dei composti non saturi mediante ozono. La reazione avviene in due fasi: nella prima si ha l’addizione di o. al legame non saturo con formazione dell’ozonuro corrispondente, nella seconda questo si decompone. Dall’analisi dei prodotti di scissione è possibile risalire alla posizione nella molecola dei legami non saturi; si usa anche per preparare aldeidi, chetoni e acidi.