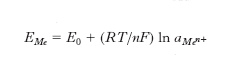elettrodi
Elementi terminali di un conduttore di corrente elettrica, interrotti per lasciare passare la corrente stessa in un fluido o in un gas. Sono e., per es., i carboni di una lampada ad arco, il catodo, la placca e le griglie di un tubo elettronico. In elettrochimica gli e. sono le sbarre o lastre di un metallo o di un semiconduttore, che vengono immerse nelle soluzioni elettrolitiche.
E. come sistemi elettrochimici
Si dicono polarizzabili se in seguito al passaggio della corrente, mutano sensibilmente le loro caratteristiche superficiali o inducono alterazioni apprezzabili nell’elettrolito. Al contrario, sono non-polarizzabili se non subiscono modificazioni di sorta, né inducono alterazioni nell’elettrolito: tipico esempio è quello di un e. metallico immerso in una soluzione, per es. satura, di un suo sale.
Un e. può anche essere detto indifferente se non partecipa ai fenomeni chimici che intervengono nell’elettrolisi; bipolare (o secondario) se, pur non essendo a contatto né con l’anodo né col catodo, ha le due facce che funzionano rispettivamente da catodo (quella rivolta verso l’anodo della cella) e da anodo (quella rivolta verso il catodo). Pertanto esso è foggiato in genere in forma di lastra ed è disposto tra anodo e catodo in una cella elettrolitica.
E. indicatori e di riferimento
Gli e. vengono anche distinti in e. indicatori ed e. di riferimento, i primi caratterizzati da un valore del potenziale che è funzione dell’attività della specie chimica alla quale sono sensibili, i secondi invece da valori costanti. Gli e. indicatori sono generalmente classificati in: a) e. indicatori di ioni metallici (e. di prima specie); b) e. indicatori di anioni (e. di seconda specie); c) e. indicatori di ossido-riduzione; d) e. a membrana. Nei primi un metallo è posto in contatto con una soluzione di suoi ioni Men+ e assume un potenziale correlato all’attività a (v) di questi nella soluzione:
,
dove E0 è una costante, il cui valore dipende dal metallo considerato, R è la costante dei gas, T la temperatura termodinamica, n il numero di elettroni scambiati, F la costante di Faraday. Nei secondi un metallo ricoperto da un suo sale poco solubile è messo in contatto con una soluzione dell’anione del sale e il potenziale assume un valore che è funzione dell’attività nella soluzione di questo anione; nei terzi un e. metallico nobile (Pt, Au) è messo in contatto con una soluzione contenente la specie ossidata e quella ridotta di una coppia di ossido-riduzione e il potenziale dell’e. è correlato al rapporto fra le attività delle due specie; negli ultimi infine l’e. è costituito da una membrana solida o liquida, omogenea o eterogenea, fra le due facce della quale, una a contatto con la soluzione da analizzare, l’altra con una soluzione di riferimento, si stabilisce una tensione che dipende dalla composizione della soluzione in esame.
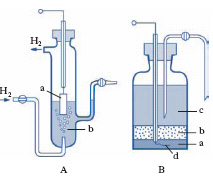
Gli e. di riferimento sono e. non-polarizzabili per i quali il valore del potenziale è rigorosamente noto e costante; essi consentono pertanto la misura del potenziale degli altri e. attraverso la determinazione della forza elettromotrice di una pila costituita dall’e. di riferimento e dall’e. del quale si vuole misurare il potenziale. Gli e. di riferimento più utilizzati sono l’e. a calomelano, l’e. ad argento/cloruro di argento/cloruro e l’e. normale a idrogeno. L’ e. normale a idrogeno (fig. A) viene realizzato ricoprendo una lamina di platino a con nero di platino ottenuto per reazione catodica elettrolizzando l’acido cloroplatinico (H2PtCl6). Il nero di platino è un deposito di platino metallico particolarmente disperso, finemente suddiviso e, quindi, molto attivo. Su tale deposito gorgoglia idrogeno gassoso alla pressione atmosferica. L’e. è immerso in una soluzione di idrogenioni b ad attività unitaria. Ai fini della stabilità e riproducibilità del potenziale, e quindi delle caratteristiche basilari per un e. di riferimento, è necessario un continuo accurato controllo sia dello stato superficiale del nero di platino, che alla stregua dei comuni catalizzatori va soggetto a fenomeni di avvelenamento, sia della pressione di gorgogliamento dell’idrogeno e dell’attività dello ione idrogeno nella soluzione. Per quanto detto risultano assai più impiegati come riferimento gli e. a calomelano e a argento/cloruro di argento/cloruro. L’ e. a calomelano (fig. B) è costituito da una pasta di mercurio a cui è sovrapposto uno strato di cloruro mercuroso b (calomelano) sul quale viene stratificata una soluzione di cloruro di potassio c; nella pasta di mercurio pesca un filo di platino d per la connessione elettrica fra e. e circuito di misura. Il valore del potenziale è controllato dalla concentrazione della soluzione di cloruro. Similmente l’ e. ad argento/cloruro di argento/cloruro è costituito da un e. di argento sul quale è depositato uno strato di cloruro d’argento e che è immerso in una soluzione di cloruro di potassio la cui concentrazione determina il potenziale dell’elettrodo. Per es., per soluzioni sature di cloruro di potassio tale valore è di 0,2492 V a 20 °C.