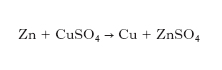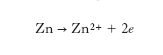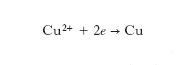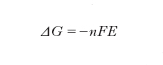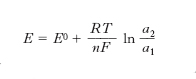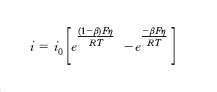elettrochimica
Parte della chimica fisica che tratta dei processi di trasformazione dell’energia chimica in energia elettrica e viceversa, e quindi si occupa in particolare delle reazioni chimiche che provocano un movimento di cariche elettriche, o sono provocate da esso.
Sistemi elettrochimici
Un tipico sistema elettrochimico è formato da due conduttori solidi separati da un conduttore ionico o elettrolitico. I conduttori solidi vengono chiamati elettrodi e sono costituiti sia da metalli sia da semiconduttori. La soluzione elettrolitica viene solitamente divisa in due parti mediante un setto poroso che la separa in due zone: una a contatto con l’elettrodo che agisce da polo negativo, o catodo, e l’altra con l’elettrodo che agisce da polo positivo, o anodo. Nel suo insieme il dispositivo descritto viene chiamato cella elettrochimica. Si indica come potenziale elettrochimico quello che assume un elettrodo metallico, immerso in un elettrolito i cui cationi siano dello stesso metallo costituente l’elettrodo, rispetto all’elettrolito medesimo. Il suo stabilirsi è dovuto al passaggio degli ioni dall’elettrodo alla soluzione e alla scarica degli ioni dalla soluzione all’elettrodo. Il potenziale elettrochimico è di solito riferito a un elettrodo, detto normale e il cui valore è per convenzione posto uguale a zero, a contatto con una soluzione nella quale gorgoglia idrogeno gassoso a 1 atmosfera.
Serie elettrochimica
È la successione che si ottiene ordinando i metalli secondo il loro potenziale elettrochimico. Questa serie ha importanza perché permette di prevedere diversi aspetti del loro comportamento; in particolare, ogni elemento a potenziale più alto si comporta come ossidante rispetto agli elementi a potenziale più basso. In un sistema elettrochimico si possono avere reazioni chimiche nelle quali l’energia chimica del sistema si trasforma in energia elettrica, come avviene nelle pile e negli accumulatori. Un esempio tipico è la pila di Daniell costituita da un catodo di zinco a contatto con una soluzione di ZnSO4, separato mediante un setto da un anodo di rame immerso in una soluzione di CuSO4. Il processo elettrochimico sfrutta la variazione ΔG di energia libera della reazione:
in base alla quale il catodo di zinco si scioglie sotto forma di solfato, mentre il rame proveniente dal solfato in soluzione si deposita sull’anodo. Più precisamente gli atomi di zinco del catodo passano in soluzione sotto forma di ioni:
dove e indica un elettrone, mentre nella zona anodica gli ioni rameici catturano due elettroni e si inseriscono nel solido:
Pertanto perché la reazione avvenga è necessario che nel circuito fluiscano due elettroni.
In questi casi il sistema viene chiamato generatore e la forza motrice del processo si identifica con la variazione di energia libera associata alla trasformazione chimica in gioco. In condizioni di reversibilità termodinamica si può scrivere:
dove al primo membro figura la variazione dell’energia libera di Gibbs; F è la costante di Faraday uguale a 96.500 coulomb/mole, n il numero di elettroni coinvolti nella reazione ed E la differenza di potenziale, o forza elettromotrice (f.e.m.), che si manifesta agli elettrodi. Un importante risultato dell’applicazione dell’equazione precedente è la deduzione della dipendenza della f.e.m. dalle concentrazioni dei reagenti nelle due zone della cella, che risulta espressa dalla seguente relazione detta di Nernst:
dove R è la costante dei gas, a l’attività dei reagenti nelle due zone elettroniche e infine E0 la f.e.m. quando i valori delle attività sono unitarie. In realtà l’equazione precedente vale in condizioni di equilibrio in corrispondenza del quale le velocità delle reazioni in gioco sono nulle e di conseguenza risulta nulla anche l’intensità di corrente i che fluisce nel sistema. Infatti perché una reazione elettronica possa avere luogo è necessario applicare una sovratensione η che esprime la distanza dal potenziale di equilibrio. Risulta allora che l’intensità della corrente si può esprimere mediante l’equazione di Butler-Volmer:
dove i0 è una costante caratteristica per ciascun particolare elettrodo, chiamata densità della corrente di scambio, e β un parametro detto coefficiente di trasferimento compreso fra zero e uno.
Alternativamente si possono provocare trasformazioni chimiche conseguenti a un passaggio forzato di energia elettrica, come avviene nell’elettrolisi delle soluzioni acquose o dei sali fusi. L’e. trova pertanto impiego nelle attività industriali che utilizzano la corrente elettrica come mezzo per la produzione di composti (➔ elettrosintesi) per la separazione di metalli. In entrambi i casi menzionati le reazioni chimiche sono confinate alle interfasi elettrodi-soluzione, per cui solo un numero limitato di molecole, all’incirca 1015 per cm2 di interfase, rimane coinvolta rispetto a una grande massa di soluzione.
Oltre che allo studio sistematico di tali reazioni, l’e. si occupa anche dei fenomeni di interesse chimico o tecnologico, connessi con il passaggio forzato della corrente in particolari materiali. Tale passaggio è sempre accompagnato da sviluppo di calore. Questo effetto in alcuni casi può assumere importanza preponderante per la possibilità di ottenere temperature molto più alte di quelle realizzabili nei comuni forni industriali e perciò atte per realizzare particolari processi quali la fabbricazione del carburo di calcio, l’elettrometallurgia ecc.
Equivalente elettrochimico
È la massa di un elemento che si deposita su uno degli elettrodi di una cella elettrolitica al passaggio della carica di 1 coulomb; si ottiene dividendo il grammo-equivalente per la carica di un Faraday.