solforico, acido
solforico, acido Composto chimico contenente lo zolfo esavalente, di formula H2SO4. È un liquido incolore, inodore, fortemente corrosivo, di consistenza oleosa o sciropposa, solubile in acqua in tutti i rapporti con forte sviluppo di calore. È un acido diprotico, che in soluzione acquosa dà vita a una prima dissociazione praticamente completa e a una seconda parziale; attacca tutti i metalli, tranne oro e platino; dei metalli comuni il piombo presenta buona resistenza; il ferro è attaccato dall’acido diluito ma pochissimo da quello concentrato. L’acido s., che corrisponde esattamente alla formula H2SO4 (non diluito e non contenente SO3 disciolta), si dice monoidrato (perché formato da una molecola di acqua e da una di anidride s.); ha una densità di 1,839 g/cm3, pari a 66° Baumé.
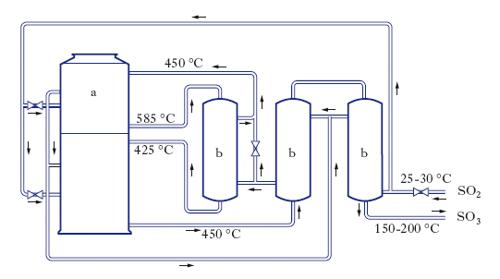
L’acido s. si rinviene eccezionalmente in natura allo stato libero (per es., nelle acque del Río Tinto, in Spagna), e forma, allo stato di solfato, molti minerali (per es., il gesso è solfato di calcio biidrato); negli organismi entra nella composizione di particolari glicoprotidi e viene utilizzato dal fegato nella sintesi protettiva di alcuni prodotti del metabolismo proteico (indolo, scatolo ecc.), tossici per l’organismo. La produzione industriale dell’acido s. si basa sull’ossidazione dell’anidride solforosa SO2 ad anidride s. SO3 e nella successiva combinazione di questa con l’acqua. La reazione d’ossidazione si compie con il sistema di contatto (o catalitico), basato su un tipico processo di catalisi eterogenea. Essendo la reazione di ossidazione (SO2+0,5O2 ⇄ SO3) fortemente esotermica, al diminuire della temperatura aumenta la conversione all’equilibrio; tuttavia, alle temperature richieste per avere conversioni quasi quantitative in SO3, la cinetica della reazione risulta troppo depressa. È necessario, perciò, operare in presenza di un catalizzatore; il platino supportato su amianto, usato in passato, è stato sostituito dal pentossido di vanadio (puro o supportato su gel di silice, con sali di potassio come promotori) che risulta meno sensibile del platino ai veleni ed è attivo nel campo di temperature compreso fra 400 e 600 °C. Il progetto dei reattori in cui avviene la conversione di SO2 in SO3 deve tener conto dell’esigenza di sottrarre il calore di reazione in modo da mantenere il profilo ottimale di temperatura. Pertanto, il letto di catalizzatore è suddiviso in due o più strati e il calore prodotto dalla reazione viene asportato tramite scambiatori di calore interni disposti fra gli strati o immersi dentro gli strati stessi. Come fluidi refrigeranti si usano i gas solforosi freddi che si preriscaldano fino alla temperatura di reazione o l’aria impiegata per la combustione dello zolfo (quando questo è il sistema per produrre SO2) o acqua (con conseguente produzione di vapore surriscaldato). Sempre più diffuso è l’impiego di reattori in cui il calore di reazione viene sottratto in scambiatori di calore esterni: la fig. illustra un convertitore di questo tipo, mostrando altresì le temperature raggiunte nelle varie parti dell’impianto. Il gas uscente dai convertitori contiene anidride s., che per reazione con acqua si trasforma in acido s. (SO3+H2O ⇄ H2SO4) con sviluppo di calore. In pratica l’assorbimento del gas, anziché con acqua, si fa in acido s. concentrato al 98% (il che evita la formazione di nebbie persistenti). L’acido può assorbire anche forti percentuali di SO3 (variabili a seconda della temperatura e della concentrazione di anidride s. presente nel gas); la soluzione si presenta come un liquido oleoso, che fuma all’aria e prende il nome di oleum (detto in passato olio di vetriolo, denominazione un tempo in uso per indicare anche l’acido s. stesso). Questo può essere usato tal quale o trasformato in acido s. per aggiunta di acqua.
Con il sistema di contatto si ottengono conversioni di SO2 in SO3 dell’ordine del 96-98%. Tali rese possono non essere sufficienti a ridurre il tenore residuo di SO2 nei gas di scarico ai valori richiesti dalla normativa antinquinamento. Per aumentare le rese di conversione in SO3 fino al 99,5-99,7% si sono diffusi i sistemi detti di doppia catalisi, in cui l’aumento della resa è ottenuto facendo avvenire la reazione in due stadi successivi, dopo ciascuno dei quali viene assorbita l’anidride solforica prodotta. Il sistema della doppia catalisi comporta una maggiore complessità d’impiego in quanto i gas uscenti dal primo stadio, prima di andare alla torre di assorbimento, devono essere raffreddati e poi, dopo l’assorbimento, nuovamente riscaldati per poter essere immessi nel secondo stadio di catalisi nelle condizioni termiche ottimali. Essendo la reazione di conversione di SO2 in SO3 termodinamicamente favorita da un aumento di pressione, hanno cominciato a diffondersi dagli anni 1990 impianti di conversione in cui la pressione è intorno a 4-8 bar; si ottengono rese di conversione del 99,8% (operando con il sistema di doppia catalisi), con un minor impiego di catalizzatore e con conseguenti minori costi di impianto (peraltro accompagnati da maggiori costi di esercizio dovuti ai più elevati consumi energetici).