silice
silice Biossido di silicio, di formula SiO2. Allo stato libero o combinato è uno dei costituenti più abbondanti della crosta terrestre; può esistere in diverse forme cristalline, criptocristalline e amorfe.
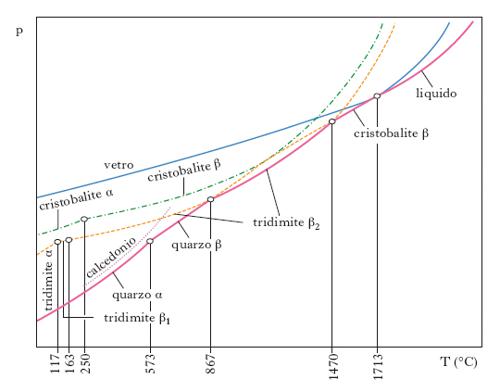
In natura esistono tre principali fasi cristalline, con varie modificazioni: il quarzo α, stabile fino a 573 °C, e il quarzo β, stabile da 573 °C a 870 °C; la tridimite α, esistente fino a 117 °C ma instabile, la tridimite β1, esistente da 117 °C a 163 °C ma sempre instabile, la tridimite β2, esistente sopra 163 °C e stabile fra 870 °C e 1470 °C; la cristobalite α, instabile ma esistente fino a 250 °C, e la cristobalite β, esistente sopra i 250 °C e stabile fra 1470 °C e 1713 °C (v. fig.). La velocità di trasformazione di una forma stabile nell’altra è estremamente lenta e in alcuni casi la trasformazione è praticamente realizzabile soltanto in presenza di catalizzatori; così, la trasformazione quarzo α-tridimite α a 867 °C è possibile soltanto in presenza di tungstato di sodio. La velocità di trasformazione delle fasi metastabili è invece molto elevata e perciò il passaggio da una forma all’altra può essere considerato reversibile. Delle tre forme cristalline esistenti in natura, la più abbondante è il quarzo, reperibile anche nella forma microcristallina nota con il nome di calcedonio.
Oltre che in queste fasi cristalline, la s. può esistere in natura in altre fasi: la coesite, monoclina e pseudoesagonale, e la stishovite, tetragonale (entrambe queste fasi hanno origine in condizioni di alta temperatura e pressione); la melanoflogite, cubica, di bassa temperatura; la s. vetrosa (lechatelierite); la s. amorfa (opale).
Le proprietà chimiche della s., sia amorfa sia cristallina, sono simili; le eventuali differenze di comportamento sono di carattere cinetico; la s. è praticamente insolubile in acqua, è inattaccabile dagli acidi, con la sola eccezione dell’acido fluoridrico, che la trasforma in tetrafluoruro, SiF4, volatile. Per riscaldamento con tricloruro di fosforo si forma il tetracloruro di silicio, SiCl4, volatile e per riscaldamento con zolfo si forma il solfuro SiS2. Ad alta temperatura il magnesio e l’alluminio riducono la s. a silicio metallico. Le soluzioni alcaline o di carbonati alcalini, a caldo, attaccano con facilità il gel di s. trasformandolo in silicati alcalini solubili; l’attacco è molto più lento con la s. vetrosa e ancora più lento con il quarzo.
Gel di s. S. colloidale polimerizzata e parzialmente disidratata; si presenta in granuli translucidi, duri, di elevata superficie specifica (350-800 m2/g), con grande volume di pori (0,4-1 cm3/g). Si prepara per coagulazione della s. idrata, ottenuta acidificando una soluzione di silicato di sodio o di un estere dell’acido silicico; il gel coagulato viene poi lavato e disidratato. Il gel di s. viene impiegato come adsorbente per disidratare gas e liquidi, per separare selettivamente alcol e idrocarburi (l’affinità di adsorbimento decresce passando dagli alcol agli idrocarburi aromatici, alle diolefine, alle olefine, alle paraffine e agli idrocarburi naftenici), per concentrare e separare antibiotici e vitamine e per frazionare steroidi; è anche usato come fase stazionaria in cromatografia e come catalizzatore e supporto di catalizzatori. Silicizzazione In botanica, impregnazione con s. delle membrane delle cellule epidermiche. È frequente negli Equiseti, nelle Poacee, nelle Ciperacee e in varie Palme. Tali epidermidi, specie da secche, sono aspre al tatto e perciò si usavano le foglie o i fusti di alcune delle piante citate per pulire superfici metalliche o vetrose. Tipica è anche la silicizzazione di parte delle membrane delle Diatomee.
In petrografia, impregnazione o epigenesi da parte della s. (quarzo, calcedonio, opale) di una roccia preesistente. Questo processo porta nei sedimenti, durante la diagenesi, alla sostituzione dei cementi calcitici con cementi quarzosi; ne deriva la formazione di una struttura a mosaico.
Trattamento termico di indurimento superficiale degli acciai, specie a basso tenore di carbonio, che vengono riscaldati a circa 950 °C insieme a carburo di silicio o a ferro-silicio in atmosfera di cloro; in queste condizioni si forma tetracloruro di silicio, che, a contatto della superficie del pezzo da trattare, si decompone depositando silicio e liberando cloro; quest’ultimo, reagendo con il carburo di silicio, dà altro tetracloruro, che torna a decomporsi nel modo detto. Si forma uno strato superficiale, di notevole durezza, particolarmente resistente all’usura e alla corrosione, contenente fino al 14% circa di silicio. Silicofilia Tendenza di organismi, specialmente vegetali, a vivere in ambienti particolarmente ricchi di s. (contrapposta a silicofugia). Se la s. è richiesta in concentrazioni molto elevate dalla pianta, si ha la silicotrofia, che è propria anche di organismi animali acquatici con scheletro siliceo, come Radiolari e Silicosponge.
Silicosi Pneumoconiosi provocata dall’inalazione di s., che colpisce minatori, cavatori, lavoratori delle industrie dei refrattari, della ceramica, del vetro. È caratterizzata da bronchite cronica e insufficienza respiratoria, dovuta alla graduale sostituzione del parenchima polmonare con tessuto fibroso. Non rare, nelle forme inveterate, sono le complicazioni infettive (specie di natura tubercolotica: silicotubercolosi) e quelle circolatorie (cuore polmonare cronico).
Nodulo silicotico Lesione anatomopatologica elementare della pneumoconiosi; è rappresentato da un granuloma costituito da macrofagi che hanno inglobato particelle di silice, da fibre reticolari e collageni ecc.