calcio
Chimica
Elemento chimico del gruppo dei metalli alcalino-terrosi; simbolo Ca, numero atomico 20, peso atomico 40,08, di cui sono noti diversi isotopi stabili: 4020Ca, 4220Ca, 4320Ca, 4420Ca, 4620Ca, 4820Ca. È un metallo tenero (durezza Mohs 1,5), duttile e malleabile, di aspetto bianco argenteo, densità 1,55 g/cm3, punto di fusione 845 °C, punto di ebollizione 1240 °C. All’aria ingiallisce combinandosi con l’azoto; con l’acqua reagisce dando idrato di c. e sviluppando idrogeno; non è pericoloso a maneggiarsi e può essere lavorato (pressato, trafilato, tornito ecc.). Si comporta da metallo bivalente, si scioglie negli acidi formando i sali corrispondenti.
Data la sua reattività il c. si trova solo in forma combinata. Il c. è, dopo il ferro e l’alluminio, il metallo più diffuso nella crosta terrestre, sotto forma di solfato, fosfato, carbonato, fluoruro ecc.
Preparazione e utilizzi
Il c. fu ottenuto per la prima volta da H. Davy nel 1808. Si prepara per elettrolisi del cloruro di c. fuso o per riduzione dell’ossido di c. con alluminio in storte di acciaio al nichel-cromo a temperatura sui 1200 °C, sotto vuoto. L’elettrolisi si compie di solito in crogioli di porcellana o di grafite; sono utilizzati anodi di carbone di storta e catodi di ferro e il bagno elettrolitico è costituito da una miscela fusa di cloruro e fluoruro di calcio.
Il c. si usa allo stato metallico in lega con l’alluminio, con il berillio, il magnesio, il piombo (la sua aggiunta serve a modificare la grana cristallina o le proprietà meccaniche), come agente in alcune sintesi organiche, per disidratare l’alcol, per purificare i gas rari dall’ossigeno e dall’azoto, per desolforare le benzine, come disossidante e decarburante degli acciai ecc. Si usa anche negli impasti cementizi perché sviluppando idrogeno a contatto dell’acqua permette di ottenere manufatti porosi. L’isotopo radioattivo 4520Ca è usato come tracciante nello studio del metabolismo del calcio.
Composti
Carburo di c.
Composto chimico, CaC2; noto in quattro forme allotropiche: la forma cubica, stabile al disopra di 447 °C, quella tetragonale, stabile tra 25 e 447 °C, e due forme a simmetria più bassa, di cui una è stabile al di sotto di 25 °C e l’altra è conosciuta soltanto come fase metastabile. Allo stato puro si presenta in masse durissime e incolori, inodori, che fondono a 2300 °C senza decomporsi. Industrialmente, si ottiene trattando al forno elettrico un miscuglio di ossido di c. e di coke o di antracite. Reagisce rapidamente con acqua a temperatura ordinaria secondo la reazione:
CaC2+ 2H2O ⇄ Ca (OH)2+ C2H2,
sviluppando acetilene. Alla temperatura di circa 1000 °C assorbe azoto trasformandosi completamente in calciocianammide. È impiegato per la fabbricazione dell’acetilene e della calciocianammide; e, limitatamente, come riducente nella metallurgia del magnesio e del silicio.
Cloruro di c.
Sale dell’acido cloridrico, noto nella forma anidra CaCl2 e in quattro forme idrate. In natura si trova nel minerale tachyhydrite (2MgCl2•CaCl2•12H2O) e in piccole quantità disciolto nell’acqua del mare e in diverse acque minerali. Si presenta in cristalli bianchi o incolori (l’esaidrato), inodori, di sapore salino, fortemente igroscopici, molto solubili in acqua e alcol. Allo stato idrato si prepara per reazione dell’acido cloridrico con il carbonato di c., nell’industria è anche ottenuto come sottoprodotto nella fabbricazione della soda con il processo Solvay. È impiegato, nella forma idrata, come stabilizzante del terreno, come ingrediente di miscele e di soluzioni frigorifere, come sostanza antigelo, come antipolvere, come ingrediente per vernici antincendio, nella conservazione di alimenti ecc.; viene aggiunto al cemento (1-2%) per migliorarne la velocità di indurimento e le proprietà meccaniche; nella forma anidra è usato come disidratante.
Fosfato di c. monobasico
Sale acido, Ca (H2PO4)2, solubile in acqua e negli acidi, insolubile in alcol; si ottiene sciogliendo il fosfato tricalcico o bicalcico in acido fosforico e lasciando evaporare la soluzione. Alla temperatura di 100 °C perde la sua acqua di idratazione, a 200 °C si decompone. Il suo impiego principale è però come fertilizzante, e a tale scopo viene preparato in notevoli quantità dalle fosforiti e dal fosfato di ossa per reazione con acido solforico. Il prodotto che si ottiene è una miscela di fosfato e di solfato di c. (in commercio prende il nome di perfosfato).
Fosfato di c. bibasico
Sale acido, CaHPO4•2H2O; è una polvere bianca microcristallina, insapore e inodore, insolubile in alcol, poco solubile in acqua; si prepara per reazione fra fosfato bisodico e un sale di calcio. Per riscaldamento a 150 °C perde l’acqua di idratazione e si trasforma nel sale anidro. È impiegato nell’industria del vetro, in medicina (nell’osteoporosi), come additivo degli alimenti per animali, come fertilizzante.
Fosfato di c. tribasico
Sale neutro dell’acido fosforico, Ca3 (PO4)2; si ottiene per reazione del cloruro di c. con il fosfato di sodio neutro o per neutralizzazione dell’acido fosforico con il latte di calce; è una polvere bianca amorfa o microcristallina, inodore e insapore, insolubile in acqua e in alcol, solubile negli acidi. Viene impiegato nell’industria ceramica, come mordente in tintoria, come chiarificante nell’industria dello zucchero, come ingrediente di paste dentifricie e in medicina come assorbente e antidiarroico, e come reintegrante del tessuto osseo. In natura è molto diffuso (fosforite), costituisce la materia prima nel processo industriale di fabbricazione dei perfosfati.
Idruro di c.
Composto chimico, CaH2, che si ottiene per combinazione diretta dagli elementi alla temperatura di circa 350 °C. Allo stato puro si presenta in masse cristalline di colore bianco; il prodotto in commercio, invece, è in genere un solido di colore più o meno grigiastro, contenente impurezze di nitruri e di c. metallico. A 600 °C si decompone con sviluppo di idrogeno. Reagisce con l’acqua secondo la reazione:
CaH2+ 2H2O ⇄ Ca(OH)2+ 2H2.
L’idruro di c. è principalmente impiegato come riducente nella metallurgia del cromo e dello zirconio; a differenza dei comuni riducenti (magnesio, alluminio ecc.) può operare, in atmosfera di idrogeno, a temperature molto elevate. È inoltre impiegato come agente disidratante di oli per trasformatore, di solventi alogenati ecc.
Astronomia
Il c. è presente in tutto l’universo, sia nelle stelle (nel Sole ha un’abbondanza relativa del 0,008%) sia negli spazi interstellari, nella proporzione di un atomo per ogni 100.000 atomi di idrogeno (c. interstellare).
Botanica
Nei vegetali il c. svolge diverse funzioni: antitossica, in quanto riduce l’effetto nocivo delle soluzioni singole di sodio, potassio e magnesio; equilibratrice, perché regola l’assorbimento degli altri ioni; costruttiva, giacché esso forma, come pectato di c., le lamelle mediane delle pareti cellulari; regolatrice della traslocazione dei carboidrati e del loro accumulo nei semi. La carenza del c. provoca vari disturbi, in alcuni casi arresto di sviluppo e fragilità dei tessuti.
Il processo d’infiltrazione di carbonato di calcio nelle membrane cellulari delle piante (calcarizzazione) è molto vistoso in certe alghe (per es. Dasicladacee e Corallinacee).
Fisiologia e medicina
Il c. è uno dei bioelementi più importanti, costituente essenziale di tutte le cellule viventi. Il metabolismo del c. è regolato dalla vitamina D, dal paratormone e dalla calcitonina. Nell’uomo il 99% del c. totale è presente come costituente del tessuto osseo. La quota presente in tutto il resto dell’organismo, pur percentualmente esigua, esplica numerose importanti funzioni: nel liquido intracellulare è essenziale per l’attività di numerosi sistemi enzimatici, alcuni dei quali interferiscono sulla contrazione del muscolo e sulla trasmissione dell’impulso nervoso; nel liquido extracellulare la concentrazione del c. deve essere mantenuta a determinati livelli, attraverso meccanismi omeostatici a cui sono interessati il tessuto osseo, l’attività renale e intestinale, il paratormone e la calcitonina, gli enzimi e i fattori che regolano la coagulazione del sangue, la mineralizzazione dell’osso ecc.
Il c. presente nel sangue è distinto in due frazioni: diffusibile e non diffusibile. Il primo (detto anche ultrafiltrabile) corrisponde al 55-65% del c. totale ed è costituito al 90% da c. ionizzato e al 10% da c. non ionizzato (citrato, solfato, fosfato, carbonato); l’attività fisiologica è esercitata solo dal c. ionizzato. Il c. non diffusibile (o non ultrafiltrabile) è combinato alle proteine plasmatiche, prevalentemente albumine. I valori normali della calcemia sono compresi fra i 9 e gli 11,5 mg/100 ml di siero per il c. totale e fra 5,5 e 6,5 mg/100 ml per il c. diffusibile. In condizioni morbose i valori possono presentare variazioni sia in aumento (ipercalcemia), sia in diminuzione (ipocalcemia).
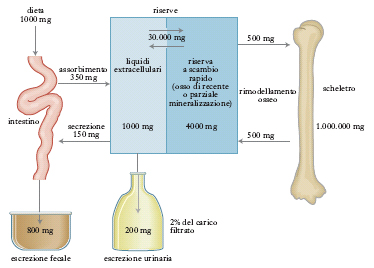
Il c. degli alimenti viene assorbito dall’intestino tenue sotto forma di sali inorganici solubili (v. fig.). Tra il c. fissato nelle ossa e quello in circolo nei liquidi organici esiste un equilibrio dinamico: un carente apporto alimentare o un deficit nell’assorbimento intestinale provoca la mobilitazione di c. osseo (necessario per mantenere costante la calcemia), con conseguente fragilità delle ossa stesse. L’ingestione di una sufficiente dose giornaliera di c. è quindi necessaria sia ai fini di un normale accrescimento, sia per salvaguardare il trofismo osseo. La razione ottimale giornaliera di c. è valutata intorno a 0,5-0,8 g per l’uomo adulto. Fra gli alimenti sono particolarmente ricchi di c. il latte e i formaggi.
L’eliminazione del c. avviene per circa 2/3 attraverso l’intestino (sali insolubili) e per 1/3 attraverso il rene (sali solubili). La quantità di c. eliminata con le urine nelle 24 ore (calciuria) varia notevolmente in rapporto al tipo di alimentazione e soprattutto in condizioni di alterato metabolismo del calcio.
La deposizione di sali calcarei in seno ai tessuti (calcificazione) è un processo a seconda dei casi fisiologico o patologico, che si verifica in condizioni varie: accrescimento delle ossa, sviluppo dei denti, malattie vascolari, come l’arteriosclerosi, riparazione di lesioni parenchimali, specialmente dell’apparato respiratorio.
La formazione nell’organismo di diffusi depositi di sali di c. (calcinosi) può essere generalizzata, interessando il tessuto sottocutaneo, i muscoli, il cuore, lo stomaco, le arterie ecc., oppure può essere localizzata a un solo organo. calcioCalcinosi cerebrale Nota anche come malattia di T. Fahr, attacca il sistema nervoso centrale, tipicamente nei nuclei della base, inducendo gravi sintomi extrapiramidali e mentali. calcioCalcinosi cutanea Consiste in accumuli circoscritti di consistenza lapidea nella cute o nel sottocutaneo; si osserva raramente, specie come complicazione di alcune malattie cutanee (sclerodermia, poichilodermia). calcioCalcinosi interstiziale Si verifica negli interstizi del tessuto connettivo. calcioCalcinosi localizzata Si osserva nei tessuti periarticolari, specialmente dei segmenti distali degli arti. calcioCalcinosi universale Propria dell’età giovanile e di origine incognita, si osserva nel sottocutaneo del tronco e dell’estremità e nei connettivi perimuscolari e perinervosi degli arti; si ritiene un’affezione primaria del mesenchima analoga alla sclerodermia.