orbitale
In fisica atomica, o. atomico, la funzione d’onda associata a un elettrone in un determinato stato di un determinato atomo, mediante la quale risultano definiti l’energia e il momento della quantità di moto orbitale di un elettrone; analogamente, si dicono o. molecolari le funzioni d’onda associate agli elettroni degli atomi di una molecola.
O. atomici
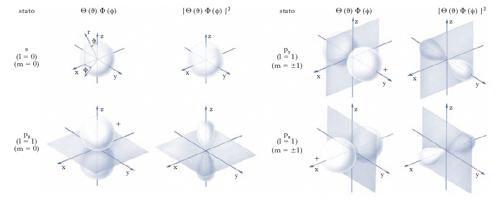
La soluzione Ψ dell’equazione di Schrödinger per un elettrone legato di un atomo può essere espressa, in coordinate sferiche r, ϑ, ϕ, con origine nel nucleo, dal prodotto di tre funzioni, ognuna funzione di una sola variabile, Ψ(r, ϑ, ϕ) = R(r)Θ(ϑ)Φ(ϕ), dove R è la parte radiale, Θ e Φ sono le parti angolari della soluzione medesima. Lo stato energetico e la configurazione spaziale rappresentati dalla Ψ risultano attraverso i numeri quantici: n (principale), l (azimutale), m (magnetico), s (di spin); o. aventi la stessa energia ma diversa configurazione spaziale sono detti degeneri; nella tabella sono indicate le espressioni per R(r) e per il prodotto Θ(ϑ)Φ(ϕ) negli stati energetici fondamentali e primi eccitati per un atomo ‘idrogenoide’ (cioè privato di tutti i suoi elettroni a eccezione di uno): Z è il numero atomico, mentre a0=0,529 Å è il raggio di Bohr, cioè il raggio della prima orbita elettronica nel modello di Bohr dell’atomo di idrogeno. Si osservi che gli stati s, con l=0, m=0, sono caratterizzati da un comportamento indipendente dalla direzione rispetto al nucleo; in una rappresentazione grafica di Θ(ϑ)Φ(ϕ) e di ∣Θ(ϑ)Φ(ϕ)∣2, contributo angolare alla densità di probabilità di presenza dell’elettrone (fig. 1), un tale comportamento degli stati s risulta rappresentato da una superficie sferica. Per gli stati p, corrispondenti a l=1, la superficie rappresentativa è a doppia goccia, come indicato in fig. 1, e il suo assetto dipende dal valore di m. Ricordiamo al riguardo che per un atomo in un campo magnetico l’energia dipende dall’assetto dell’o. nel campo medesimo. In fig. 1 è indicato anche il segno assunto dalla Ψ: si osservi che i due lobi di cui è composto l’o. p sono simmetrici rispetto a un piano, detto piano nodale, indicato in fig. 1, dove la Ψ risulta nulla. La presenza e la determinazione degli elementi di simmetria di un o. possono talora semplificare la conoscenza del sistema atomico, permettendo l’assegnazione dei numeri quantici relativi. Per quanto riguarda la parte radiale R(r), il quadrato ∣R(r)∣2 dà la densità di probabilità di presenza di un elettrone alle varie distanze r dal nucleo: la probabilità che un elettrone sia presente a distanza compresa tra r e r+dr dal nucleo vale il prodotto di ∣R(r)∣2 per l’elemento di volume 4πr2dr. Le distanze dal nucleo per le quali la probabilità assume i valori massimi corrispondono ai raggi delle orbite elettroniche della teoria di Bohr. Per sistemi atomici a più elettroni, trattazioni quantitative si possono fare mediante funzioni d’onda semplici del tipo idrogenoide: precisamente, la funzione d’onda totale si esprime come combinazione di funzioni d’onda idrogenoidi. Si ottiene così un’approssimazione in cui si ignorano le interazioni tra gli elettroni, di cui si cerca poi di tenere conto considerando come carica nucleare che agisce sugli elettroni una carica efficace, minore di quella vera a causa dell’effetto di schermo degli elettroni interni nei confronti di quelli più esterni.
Una particolare attenzione va posta alle direzioni degli o. leganti, che dovranno rendere conto della struttura stereochimica della molecola. Particolarmente interessante è il caso dell’atomo di carbonio nella molecola del metano, CH4, per il quale J.H. van’t Hoff ha dimostrato che i quattro legami con gli atomi di idrogeno sono equivalenti e quindi devono disporsi secondo una struttura tetraedrica attorno all’atomo di carbonio. Una tale struttura non può essere ottenuta con due soli elettroni negli o. 2p del carbonio; invece, combinazioni lineari degli o. 2s e 2p possono dar luogo a quattro nuovi o. atomici; tali o. sono detti o. ibridi e sono indicati con le lettere che individuano le funzioni d’onda utilizzate nella combinazione; per es., nel caso del metano, si hanno gli o. ibridi sp3, in quanto risultanti dalla combinazione di un orbitale s e tre p.
O. molecolari
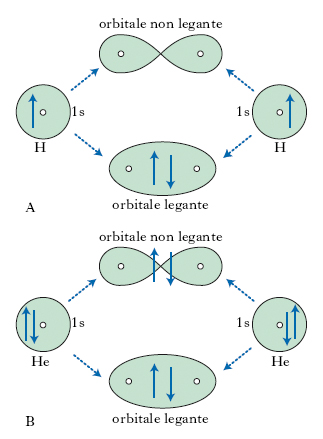
Un o. molecolare è la funzione d’onda relativa alla configurazione spaziale di un elettrone in una molecola. Tramite gli o. molecolari è possibile ottenere informazioni quantitative e semiquantitative sull’energia dei legami che caratterizzano la molecola. In generale, il modo più semplice di costruire un o. di questo tipo è quello di combinare gli o. atomici degli elementi costituenti la molecola, cosa che si può fare con vari metodi: il più semplice è quello della combinazione lineare di o. atomici (metodo LCAO). Questo metodo considera soltanto quegli elettroni (detti di valenza) degli o. atomici più esterni trascurando il contributo degli elettroni ‘più interni’ alla formazione del legame. Questa approssimazione porta a risultati in ottimo accordo con i dati sperimentali nello studio delle molecole più comuni. A seconda del tipo di combinazione, si possono avere o. molecolari di tipo σ che si realizzano, per es., nella sovrapposizione di o. atomici s, o di tipo π che si realizzano per es., in una particolare sovrapposizione di o. atomici p. La configurazione che si realizza è tale che per i primi si ha il massimo della densità elettronica nella zona che corrisponde all’asse congiungente i due nuclei, mentre per i secondi tale zona costituisce un nodo, cioè la probabilità di trovarvi l’elettrone è nulla. Una volta che questi o., i quali forniscono un’approssimata descrizione del comportamento degli elettroni nella molecola, siano stati costruiti, gli elettroni vanno assegnati a vari o. in modo da rispettare il principio di esclusione di Pauli. La combinazione lineare di due o. atomici di norma dà luogo a due o. molecolari, uno ottenuto sommando e l’altro sottraendo le due funzioni atomiche, e corrispondenti uno allo stato legato (o. legante) della molecola e l’altro, generalmente con energia maggiore, a uno stato non legato (o. antilegante). La formazione degli o. antileganti consente di spiegare, in termini di transizione elettronica, l’eccitazione e la diseccitazione molecolare, e di correlare tale transizione alle righe o alle bande che si ottengono nell’analisi spettrale in emissione; a tale proposito, in spettroscopia molecolare sono stati evidenziati nelle molecole stati energetici, indicati con il termine di o. non leganti, in cui agli elettroni compete un’energia uguale a quella degli o. atomici non combinati. A titolo d’esempio, si consideri la fig. 2, in cui è mostrata la combinazione di o. atomici 1s nel caso della molecola dell’idrogeno e dell’elio. Nel caso dell’H2 i due elettroni dei due atomi si collocano, a spin opposti, nello stato di minore energia, cioè quello legante; nel caso dell’He, dei quattro elettroni due si collocano nell’o. legante e due in quello antilegante; non essendovi una popolazione di elettroni negli stati leganti (maggiore di quella presente negli stati antileganti), non v’è alcun guadagno di energia e quindi non si forma il legame covalente.