stereochimica
stereochimica Settore della chimica che studia gli aspetti tridimensionali dei fenomeni molecolari e, più in particolare, le relazioni esistenti tra le proprietà delle molecole e la loro struttura spaziale.
Cenni storici
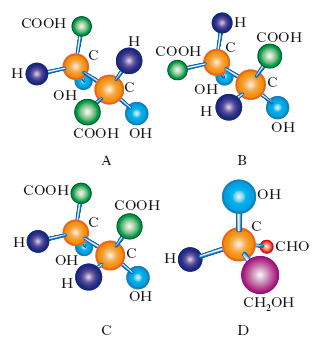
I primi passi della s. sono legati agli studi di J.F.D. Arago (1811) e J.B. Biot (1813) sulla rotazione del piano della luce polarizzata che attraversa certi mezzi trasparenti. Essi chiamarono ‘attività ottica’ questo fenomeno e mostrarono che le due forme emiedriche del quarzo (e di altri minerali) ruotavano il piano della luce polarizzata in senso opposto e, a parità di spessore e di lunghezza d’onda della luce impiegata, dello stesso numero di gradi; scoprirono, inoltre, che lo stesso fenomeno era presentato da alcune sostanze naturali liquide come la trementina e dalle soluzioni di alcune sostanze naturali solide come la canfora. Il fatto che dei liquidi o delle soluzioni fossero otticamente attivi come i cristalli emiedrici di quarzo fu attribuito a una qualche asimmetria delle molecole stesse. Dovevano passare altri 60 anni prima che si capissero l’origine e la natura di tale asimmetria. Un fondamentale passo in avanti fu compiuto con le ricerche di L. Pasteur (1848) sugli acidi tartarici e sui loro sali. Pasteur separò l’una dall’altra due forme cristalline emiedriche di tartrato doppio di potassio e ammonio. Le soluzioni acquose di queste due forme erano otticamente attive e, a parità di concentrazione, deviavano il piano della luce polarizzata in senso opposto ma con lo stesso angolo. Pasteur arrivò alla conclusione che sia l’asimmetria dell’abito cristallino sia l’attività ottica delle soluzioni dovevano essere attribuite a una asimmetria della stessa molecola dell’acido tartarico. Le due forme da lui isolate, oltre che per il senso di rotazione del piano della luce polarizzata, differivano per le loro proprietà biologiche: tutte le altre proprietà chimiche e fisiche erano identiche. Era la prima volta che due enantiomeri (o antipodi ottici) venivano separati l’uno dall’altro. Pasteur isolò anche una forma di acido tartarico con abito cristallino simmetrico, la cui soluzione acquosa non mostrava attività ottica. Quest’ultima presentava proprietà chimiche, fisiche e biologiche diverse da quelle delle due forme emiedriche.
Nel 1869 E. Paternò suggerì che l’atomo di carbonio, nei composti che lo contengono, può legarsi a 4 atomi o gruppi atomici che si dispongono attorno a esso occupando le posizioni dei vertici di un tetraedro. Dopo gli studi fondamentali di J. Wislicenus sugli acidi lattici (1873), J.-A. Le Bel (1874) e J. H. van’t Hoff (1875) capirono che se l’atomo di carbonio è legato a 4 atomi o gruppi diversi la configurazione così ottenuta non ha elementi di simmetria. Si dice allora che quell’atomo di carbonio è asimmetrico e la molecola che lo contiene è anch’essa asimmetrica e otticamente attiva; essa ammette l’esistenza di un’immagine speculare non sovrapponibile di cui è, appunto, l’antipodo ottico. Se una molecola contiene n atomi di carbonio asimmetrici essa può avere 2n isomeri ottici e cioè 2n/2 coppie di antipodi ottici. Se, come nel caso dell’acido tartarico, gli atomi asimmetrici sono equivalenti, cioè hanno gli stessi sostituenti, qualcuno degli isomeri possibili possiede un piano di simmetria e pertanto è otticamente inattivo (forma meso). Trovavano così spiegazione le osservazioni di Pasteur e agli acidi tartarici otticamente attivi venivano assegnate le formule A e B di fig. e alla forma meso la formula C.
Sostanze otticamente attive
Il numero delle sostanze otticamente attive di origine naturale, come l’acido tartarico, crebbe rapidamente; si decise di assegnare il segno positivo alle rotazioni destrogire (orarie) del piano della luce polarizzata e si scelse la gliceraldeide destrogira come sostanza di riferimento delle configurazioni: essa fu chiamata D-(+)-gliceraldeide e le fu assegnata, per convenzione, la formula D di fig. Tutte le sostanze che, indipendentemente dal valore e dal senso di rotazione del piano della luce polarizzata, erano derivabili chimicamente dalla D-(+)-gliceraldeide o da essa preparabili, venivano incluse nella serie D. L’acido tartarico levogiro si poteva ottenere per via chimica dalla D-(+)-gliceraldeide e pertanto fu assegnato alla serie D e chiamato D-(–)-tartarico. Nel 1951 J.M. Bijvoet trovò, con metodi diffrattometrici di raggi X, che l’acido tartarico destrogiro possiede realmente la struttura 1, prima assegnatagli per convenzione, e non quella della sua immagine speculare 2. Da quel momento tutte le configurazioni che prima erano relative e cioè riferite a quella dell’aldeide D-(+)-glicerica sono diventate configurazioni assolute.
Questo sistema di specificazione delle configurazioni è tuttavia molto scomodo perché non può prescindere dalla conoscenza della particolare via sintetica usata per correlare la configurazione di ciascun atomo chirale alla configurazione dell’aldeide D-(+)-glicerica. Inoltre, se una sostanza ha più di un atomo chirale, è necessario specificare a quale di essi ci si riferisce allorché si assegna questa sostanza alla serie D oppure L. Il metodo proposto da R.S. Cahn, C. Ingold e V. Prelog elimina queste ambiguità. Tale metodo assegna ai 4 sostituenti di un atomo chirale un ordine di priorità (per es., decrescente con il numero atomico). Se, osservando l’assetto tetraedrico di questi sostituenti dal punto di vista più distante rispetto al sostituente a più bassa priorità, la sequenza di priorità degli altri sostituenti è oraria, si dice che la configurazione di quell’atomo di carbonio è R (rectus); viceversa si assegna la configurazione S (sinister) se quella sequenza è antioraria.
Le sostanze otticamente attive sono molto diffuse nel regno animale e vegetale dove, di solito, si trova soltanto uno dei possibili 2n isomeri ottici. Ciò sta a significare che gli organismi viventi sono in grado di metabolizzare e di sintetizzare soltanto quello tra gli isomeri ottici che possiede la giusta sequenza nelle configurazioni dei suoi atomi di carbonio asimmetrici. Spesso tutti i componenti di una classe di sostanze naturali hanno la stessa configurazione assoluta.