sistèma periòdico degli eleménti
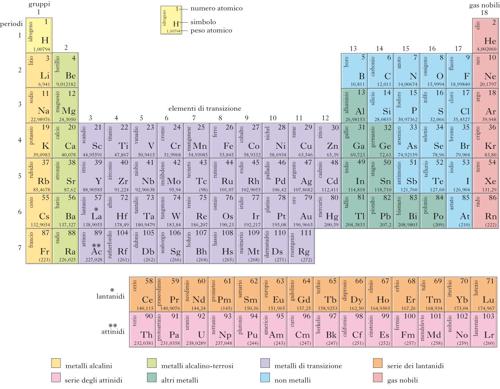
sistèma periòdico degli eleménti Classificazione degli elementi chimici organizzati in una tabella e ordinati in righe (dette periodi) secondo il numero atomico crescente e in colonne (dette gruppi) secondo l'analogia delle proprietà chimiche, in partic. della valenza, e perciò della struttura elettronica esterna dei corrispondenti atomi. Generalmente, ogni elemento è collocato in una casella contenente il simbolo, il numero atomico e il peso atomico. Il sistema periodico fonda la sua struttura sul grandioso lavoro compiuto alla metà dell'Ottocento dal chimico russo D.I. Mendeleev, che per primo ordinò gli elementi (tavola degli elementi di Mendeleev) secondo un criterio unico (allora il peso atomico) permettendo anche di prevedere l'esistenza di elementi solo successivamente scoperti e isolati.
Struttura del sistema
I periodi sono formati da un numero variabile di elementi: 2 sul 1°, 8 sul 2° e sul 3° (periodi brevi); 18 sui successivi, dal 4° al 6° (periodi lunghi). L'ultimo periodo, il 7°, è incompleto: a partire dal nettunio è formato da elementi artificiali e l'ultimo attualmente confermato dalla IUPAC porta il numero atomico 111. Sulle ultime due righe, rispettivamente alle caselle del lantanio e dell'attinio, sono associate due serie di 14 elementi dalle caratteristiche omogenee (lantanidi e attinidi). In questo modo il sistema è formato da 7 righe e da 18 colonne, che sono numerate progressivamente. Percorrendo il s.p. degli e. secondo il numero atomico crescente, dopo un certo numero di passi (8 o 18) si ripresentano elementi con caratteristiche chimiche simili (legge della periodicità).
Variazione delle proprietà chimiche lungo il sistema
Lungo un periodo, da sinistra a destra, si ha una variazione graduale delle proprietà chimiche, in partic. di quelle metalliche: il carattere metallico diminuisce dal primo al penultimo gruppo (l'ultimo gruppo essendo formato da elementi particolari, i gas nobili, non reattivi). Si ha anche un aumento del carattere metallico (e di altre proprietà collegate) all'interno di uno stesso gruppo procedendo dall'alto verso il basso. Così gli elementi dalle più spiccate caratteristiche metalliche si trovano in basso a sinistra del sistema, quelli dal carattere più non metallico in alto a destra. Gli elementi che, a partire dal 4° periodo, si trovano nei gruppi centrali del sistema (dal gruppo 3 al gruppo 12) e che 'allungano' il periodo da 8 a 18 elementi sono chiamati collettivamente elementi (o metalli) di transizione. Abitualmente hanno nomi specifici anche alcuni gruppi: oltre ai gas nobili (gruppo 18), si hanno così i metalli alcalini (gruppo 1) e i metalli alcalino-terrosi (gruppo 2, a partire però dal magnesio).