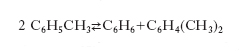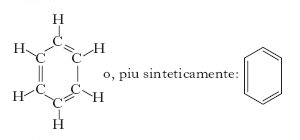benzene
Idrocarburo che in virtù della sua struttura costituisce il capostipite della serie aromatica. Ha formula C6H6 e si presenta come un liquido incolore, volatile, infiammabile, che bolle a 80,3 °C e solidifica a 5,4 °C, ha densità 0,89 g/cm3, odore gradevole, sapore bruciante, è insolubile in acqua. È largamente usato come ottimo solvente di molte sostanze organiche (alcaloidi, gomma, resine, grassi ecc.), in miscele carburanti (con benzina), come materia prima per la produzione di alcuni importanti composti (etilbenzene, cumene, cicloesano, anilina ecc.), usati nella preparazione di materie plastiche, detergenti, fibre tessili, coloranti ecc. (➔ petrolchimica).
Produzione
A causa del sempre crescente aumento della domanda avanzata dall’industria chimica, hanno avuto grande sviluppo i metodi di produzione del b., e in genere degli idrocarburi aromatici, a partire da derivati dell’industria del petrolio (➔ aromatici, idrocarburi). La produzione del toluene ottenuto insieme al b. per questa via risulta eccedere l’effettiva richiesta; pertanto sono stati sviluppati processi che trasformano il toluene in b., la cui produzione è, invece, inferiore alla richiesta. La conversione del toluene in b. può essere realizzata in due modi. Un processo è quello per disproporzione, cioè secondo la reazione:
che avviene riscaldando il toluene a 250-300°C, in presenza di catalizzatori (zeoliti ecc.) e a circa 45 bar. Un altro processo è quello della dealchilazione termica secondo la reazione:
che avviene a 550-750 °C, a 25-75 bar e in presenza di eccesso di idrogeno. Si può operare a temperatura più bassa in presenza di un catalizzatore (ossido di cromo o di molibdeno su supporto di argilla). La produzione mondiale annua di b. è dell’ordine di 15.000.000 t (circa 0,6-0,7 milioni di tonnellate in Italia).
Struttura della molecola
Fu intuita, intorno alla metà del sec. 19°, da F.A. Kekulé che, partendo dall’ipotesi della valenza fissa del carbonio uguale a 4, propose una configurazione ciclica con gli atomi di carbonio ai vertici di un esagono regolare e caratterizzata da doppi legami alternati a legami semplici:
L’interpretazione attuale della struttura del b. prevede che ogni atomo di carbonio impegni 3 elettroni di valenza mediante orbitali ibridi sp2 nella formazione di altrettanti legami covalenti (1 con l’idrogeno e 2 con gli atomi di C adiacenti nell’anello). I restanti orbitali p di ciascun atomo di carbonio, perpendicolari al piano della molecola, si combinano per formare orbitali molecolari detti π che ospitano i rimanenti 6 elettroni che sono delocalizzati su tutto l’anello (➔ aromatici, idrocarburi). Perciò ognuna delle coppie di elettroni di legame non è condivisa soltanto da due atomi di carbonio adiacenti, come si verifica nei comuni doppi legami, ma da tutti gli atomi dell’anello. La rappresentazione grafica di tale interpretazione è la seguente:
formula
Calcoli basati sulla meccanica quantistica mostrano che tale situazione elettronica è dal punto di vista energetico molto stabile, giustificando il fatto che il b. non dà luogo a reazioni di addizione che deriverebbero dalla rottura dei doppi legami presenti nella molecola se gli elettroni non fossero delocalizzati. Invece il b. tende a dare reazioni in cui uno o più atomi di idrogeno sono sostituiti da atomi o gruppi atomici monovalenti. Per es., facendo reagire il b. con l’acido nitrico, si forma il nitrobenzene, in cui un gruppo −NO2 sostituisce un atomo di idrogeno nell’anello del benzene. I sostituenti, eventualmente già presenti sull’anello, determinano sia la reattività sia la posizione che successivi gruppi entranti vengono ad assumere nella molecola: alcuni (come il gruppo ossidrilico, quello metilico e gli alogeni) orientano la sostituzione prevalentemente nelle posizioni orto e para, mentre altri (come il gruppo −NO2, quello carbossilico, quello trimetilamminico) orientano la sostituzione prevalentemente nella posizione meta.