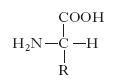amminoacidi
Composti organici caratterizzati dalla presenza nella molecola di un gruppo carbossilico, COOH, e di un gruppo amminico, NH2. Gli a. isolati in natura sono oltre 300; si possono trovare allo stato libero, nei tessuti e nei liquidi degli organismi, o legati in peptidi a basso peso molecolare.
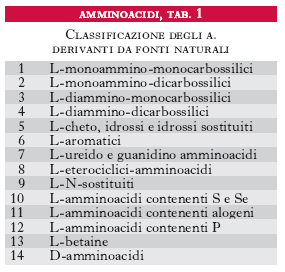
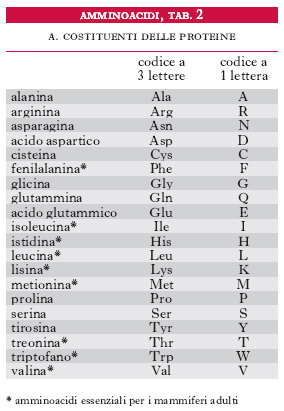
Gli amminoacidi sono i costituenti delle proteine; si uniscono l’uno all’altro attraverso il legame peptidico, che si forma per reazione fra un gruppo carbossilico di un a. e il gruppo amminico di quello successivo con liberazione di una molecola d’acqua; si formano così dei peptidi che danno luogo a lunghi polimeri lineari chiamati catene polipeptidiche; più catene polipeptidiche possono essere contenute in una molecola proteica. Gli a. costituenti le proteine vengono raggruppati in due categorie: la prima comprende i 20 a. classici per i quali è noto il codice genetico di sintesi delle proteine (tab. 1); la seconda include gli a. derivati da alcuni di questi per trasformazione enzimatica, che ha luogo quando già sono stati incorporati nella catena polipeptidica. Gli a. delle proteine sono tutti α-a., cioè il gruppo amminico si trova legato allo stesso carbonio a cui è legato il gruppo carbossilico. La formula di struttura è:
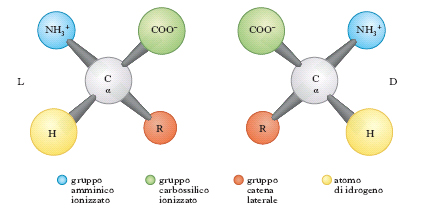
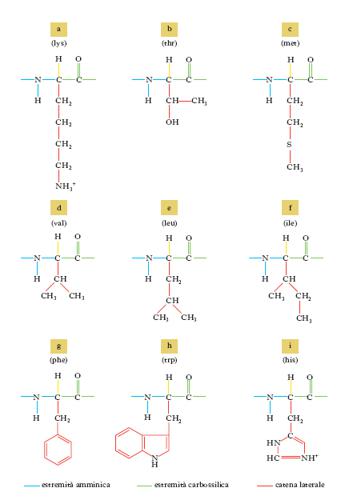
con l’eccezione della prolina che ha un gruppo imminico al posto del gruppo amminico. Il gruppo R (o catena laterale) varia da a. ad a., andando da un atomo di idrogeno della glicina a più complesse catene carboniose alifatiche o aromatiche. Tranne la glicina, tutti gli a. hanno quattro raggruppamenti atomici differenti legati al carbonio a cui è unito il gruppo amminico; esso risulta così asimmetrico e per ogni a. possono esistere gli stereoisomeri, L e D (fig. 1); gli a. della serie L hanno una configurazione assoluta paragonabile a quella della L-gliceraldeide, gli a. della serie D, paragonabile a quella della D-gliceraldeide. Solo gli L-a. sono composti biologicamente attivi e possono essere utilizzati dagli organismi viventi. Nelle proteine sono presenti solo L-a., mentre i D-a. si trovano raramente come a. liberi o in sostanze a basso peso molecolare. Gli a. sono sostanze otticamente attive, distinguendosi in destrogiri e levogiri. Uno stereoisomero della serie L può essere destrogiro (+) o levogiro (−) e se uno stereoisomero è L(+), l’altro sarà D(−).
Gli a. sono solubili in acqua entro un ampio intervallo di solubilità; sono elettroliti anfoteri capaci di esercitare un potere tampone. Sono composti particolarmente reattivi, suscettibili di numerose modificazioni; sono in grado di legare i metalli, particolarmente quelli bivalenti, e alcuni di essi hanno proprietà di assorbire radiazioni ultraviolette e infrarosse in specifici intervalli di lunghezza d’onda.
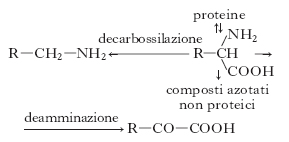
Gli a. sono componenti indispensabili nella dieta di tutti gli animali, compreso l’uomo. La maggior sorgente degli a. per i mammiferi è rappresentata dalle proteine. Le vie metaboliche generali comuni a tutti gli a. sono così schematizzabili:
Le reazioni comprendono: a) deamminazione, con formazione del chetoacido come primo prodotto del catabolismo dell’a. e finale ossidazione dello scheletro carbonioso nel ciclo degli acidi tricarbossilici; b) sintesi di composti azotati non proteici particolari (ormoni, vitamine ecc.); c) biosintesi delle proteine, d) decarbossilazione, con formazione di una ammina primaria. Gli a. sono distinti in chetogenetici e glicogenetici, in quanto la somministrazione di un particolare a. porta (spesso in particolari condizioni sperimentali) alla formazione di corpi chetonici o di glucosio, in relazione alla natura dei prodotti finali di degradazione. Dei 20 a. che costituiscono le proteine (tab. 2), 9 sono considerati essenziali per l’uomo (fig. 2), in quanto non possono essere sintetizzati nell’organismo.
La produzione di a. per uso alimentare e farmaceutico si basa su processi di estrazione da prodotti naturali, di sintesi chimica, di fermentazione. Nei processi fermentativi ci si può avvalere delle tecniche dell’ingegneria genetica che ne migliorano l’efficienza. I sistemi di preparazione degli a. per sintesi utilizzano spesso la sintesi enzimatica ed è possibile usare cellule ad alta attività enzimatica in luogo dell’enzima libero. Un esempio di rilevanza industriale è rappresentato dalla produzione dell’acido L-aspartico, che costituisce una materia prima fondamentale per la produzione dell’aspartame (➔).
Tra i principali processi sviluppati a questo scopo vi sono quelli basati sugli enzimi amminoacidoacilasi, che sono in grado di idrolizzare selettivamente solo la forma L dei due enantiomeri di un N-acetilamminoacido. Per separare le due forme D e L di un a. si può procedere allora sintetizzando per via chimica tali derivati, sottoponendoli poi alla reazione enzimatica selettiva: la forma D dell’N-acetilamminoacido resta inalterata; la forma L viene invece idrolizzata dall’enzima restituendo l’L-a., che può essere separato dalla miscela mediante una resina a scambio ionico.
Per separare e determinare gli a. si ricorre all’elettroforesi su carta ad alto voltaggio, gascromatografia dei derivati volatili degli a., cromatografia su strato sottile e cromatografia su resina a scambio ionico che si avvale di strumentazione completamente automatica. Per la separazione degli a. si usano resine a scambio ionico cationiche, copolimeri stirene-divinilbenzene, solfonate, sotto forma di particelle sferiche del diametro dell’ordine di 10 mm, diluite con tamponi a base di citrato di sodio (o di litio). La rivelazione degli a. si ottiene mediante la reazione con ninidrina, da cui si origina una colorazione con assorbimento a 5700 Å.
Con specifiche apparecchiature (analizzatori di a.) si ottengono analisi complete e precise di a. con sensibilità dell’ordine del μg per ciascun amminoacido.
Si definiscono genericamente amminoacidopatie malattie congenite caratterizzate da un blocco biochimico di una reazione metabolica che coinvolge uno o più amminoacidi. Questi, o loro derivati, si accumulano nel sangue (iperamminoacidemia) e vengono eliminati in quantità abnorme con le urine (amminoaciduria metabolica).