batteri
Microrganismi unicellulari precedentemente inclusi nel regno Procarioti, ma attualmente considerati un dominio a sé stante, quello dei Bacteria.
Numerose attività metaboliche dei b. condizionano le possibilità di vita degli altri organismi. Un certo numero esplica azione patogena, altri partecipano ai processi di degradazione enzimatica delle spoglie di animali e piante e ai cicli del carbonio, dell’ossigeno, dell’idrogeno, dell’azoto, dello zolfo, del ferro, del manganese ecc.
Altrettanto necessari sono i processi di sintesi e di trasformazione nei quali si hanno la produzione di antibiotici e vitamine e la fermentazione di varie sostanze (per es., latte, vino, orzo). Inoltre, la scoperta, avvenuta agli inizi degli anni 1970, degli enzimi batterici di restrizione-modificazione ha consentito l’utilizzazione dei b. nella tecnologia del DNA ricombinante, che ha aperto un vastissimo campo di ricerca di base e applicata.
Classificazione
Per lungo tempo si è ritenuto che il mondo vivente potesse essere diviso in procarioti ed eucarioti e che questi ultimi si fossero evoluti dai primi, più primitivi. Negli ultimi decenni del 20° sec., lo sviluppo delle tecniche di sequenziamento e dei metodi per l’analisi computazionale di particolari sequenze o strutture di proteine ha evidenziato l’enorme diversità esistente fra i procarioti. Creando un nuovo rango tassonomico, il dominio (detto anche impero o superregno), gli esseri viventi sono stati quindi divisi in Archea, Bacteria ed Eucaria. Nella vecchia classificazione i b. erano divisi in archeobatteri ed eubatteri; con la nuova sistematica i b. appartengono ai Bacteria e gli archeobatteri agli Archea. Nei Bacteria sono stati individuati 23 phyla a loro volta suddivisi in un totale di 31 classi, 70 ordini, 175 famiglie, 872 generi. I phyla sono:
I Aquificae (1 classe);
II Thermotogae (1 classe);
III Thermo;desulfobacteria (1 classe);
IV Deinococcus/Thermos (1 classe);
V Chrysiogenetes (1 classe);
VI Chloroflexi (1 classe);
VII Thermomicrobia (1 classe);
VIII Nitrospirae (1 classe);
IX Deferribacteres (1 classe);
X Cyanobacteria (1 classe);
XI Chlorobi (1 classe);
XII Proteobacteria (5 classi);
XIII Firmicutes (3 classi);
XIV Actinobacteria (1 classe);
XV Planctomycetes (1 classe);
XVI Chlamidiae (1 classe);
XVII Spirochaetes (1 classe);
XVIII Fibrobacteres (1 classe);
XIX Acidobacteria (1 classe);
XX Bacteroidetes (3 classi);
XXI Fusobacteria (1 classe);
XXII Verrucomicrobia (1 classe);
XXIII Dictyoglomi (1 classe).
Morfologia
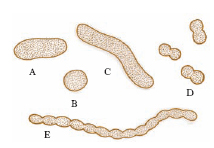
I batteri mostrano poche forme fondamentali (fig. 1): bastoncellare (bacilli), sferica (cocchi), ricurva (vibrioni, o spirilli). I b. più piccoli sinora osservati ( nanobatteri) hanno un diametro medio di 200-500 nm. Il b. più grande, scoperto nel 1999, è Thiomargarita namibiensis, sferico, con diametro di 0,1-0,3 mm, che in alcuni esemplari raggiunge anche 0,75 mm.
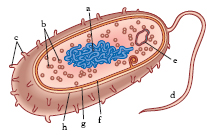
Struttura. Elemento fondamentale della cellula batterica è la presenza di una regione nucleare, detta nucleoide, che nella maggior parte dei b. contiene un singolo cromosoma circolare a doppio filamento (fig. 2). Sono stati individuati b. che presentano due cromosomi circolari (Vibrio cholerae) e b. con un cromosoma lineare (Borrelia burgdorferi). Peculiare dei b. è inoltre l’esistenza di unità genetiche accessorie, dette plasmidi. I prodotti genici codificati dai plasmidi comprendono enzimi per l’utilizzazione di fonti insolite di carbonio, come il toluene, e per la resistenza a sostanze come metalli pesanti e antibiotici. Sui plasmidi sono presenti geni che codificano fattori di resistenza agli antibiotici e numerose sostanze che condizionano le proprietà patogenetiche del batterio.
La membrana citoplasmatica ha una struttura analoga a quella degli eucarioti, tuttavia è priva di steroli. Tra le proteine della membrana citoplasmatica vi sono quelle della catena respiratoria, coinvolte nella generazione di energia. Nei b. fotosintetici, privi di cloroplasti, la membrana assume anche attività fotosintetica. A eccezione dei micoplasmi, tutti i b. possiedono un involucro esterno alla membrana citoplasmatica, la parete cellulare. Il costituente della parete cellulare batterica è il peptidoglicano, detto anche mureina, formato da una componente glucidica (due carboidrati azotati, la N-acetilglucosammina e l’acido N-acetilmuramico) e da una peptidica (variabile nei diversi gruppi batterici). Al peptidoglicano si accompagnano vari polimeri, di diversa natura chimica, organizzati e distribuiti in maniera così diversa da definire due grandi categorie tassonomiche: i b. gram-positivi e i b. gram-negativi. La maggior parte dei b. produce una varietà di polisaccaridi idrofobici o di proteine polimeriche extracellulari saldamente associati alla parete cellulare, a formare un involucro mucoso amorfo, la capsula, responsabile della resistenza alla fagocitosi e dell’adesione a cellule e a materiali di varia natura. In condizioni ambientali estreme alcuni b. hanno un’ulteriore struttura esterna di natura proteica, lo strato S che protegge le cellule batteriche dall’infezione di batteriofagi, dalla fagocitosi e dalle proteine ad attività antibatterica prodotte dall’ospite.
Alcuni b. sono ricoperti da appendici che emergono al di fuori degli involucri cellulari; queste appendici, chiamate fimbrie o pili a seconda della loro funzione, sono formate dalla ripetizione di subunità proteiche. Alcuni tipi di fimbrie conferiscono ai b. la proprietà di aderire a superfici solide, come, per es., ai tessuti dell’ospite o alle pietre dei torrenti. Una particolare classe di fimbrie è costituita dai cosiddetti pili F o pili sessuali, più lunghi delle fimbrie di adesione; nella coniugazione batterica i pili sessuali facilitano il trasferimento dell’informazione genetica da una cellula donatrice ‘fertile’ a una cellula ricevente ‘non fertile’.
Chemiotassi batterica. Molti dei meccanismi coinvolti nella segnalazione chimica fra le cellule degli animali multicellulari si sono evoluti dai meccanismi usati dagli organismi unicellulari per rispondere con il movimento a uno stimolo nutrizionale e spostarsi verso la sorgente dello stimolo. Questo processo, chiamato chemiotassi, è stato soprattutto studiato in Escherichia coli e in Salmonella typhimurium.
Alcuni batteri (bacilli, vibrioni, spirilli) si muovono per mezzo dei flagelli, il cui numero e la cui disposizione hanno un notevole valore tassonomico e diagnostico. Il flagello batterico presenta una struttura completamente diversa da quelli della cellula eucariotica ed è costituito da un tubo elicoidale formato da un unico tipo di subunità proteica, la flagellina. Ciascun flagello è attaccato mediante un corto uncino flessibile a un piccolo disco proteico immerso nella membrana plasmatica; tale disco costituisce un minuscolo motore che ruota e fa girare il flagello a esso attaccato. L’energia per la rotazione è fornita dal gradiente protonico transmembrana. Si è osservato che, se la rotazione avviene in senso antiorario, tutti i flagelli si uniscono in un fascio e il b. ‘nuota’ in modo uniforme in una direzione; se la rotazione avviene in senso orario, i flagelli si separano e il b. compie dei movimenti simili a capriole in modo caotico, senza spostarsi. Questo comportamento viene modificato in relazione alle sostanze attraenti o repellenti presenti nel terreno, le quali riconoscono i recettori di membrana specifici e si legano a essi.
Nei b. si osservano anche altri tipi di movimento, associati a flagelli strutturati diversamente. Nelle spirochete, per es., la cellula è avvolta a spirale intorno a un filamento assiale e si muove ruotando attorno a questo, come conseguenza della contrazione del filamento stesso. I b. degli ordini Myxobacteriales e Cytophagales sono indicati come b. striscianti perché si muovono sulle superfici solide per strisciamento, mediante sottili filamenti che originano da piccole sferette situate nella parete cellulare. È da notare inoltre che i flagelli sono dotati di spiccate proprietà antigeniche e costituiscono l’antigene H dei batteri.
Sporulazione. Numerosi b. gram-positivi e numerosi b. patogeni per l’uomo sono in grado di formare una caratteristica struttura cellulare resistente e quiescente, detta endospora o spora batterica. Sono state ritrovate alcune spore batteriche capaci di germinare e ripristinare la forma vegetativa dopo oltre 500 anni.
Metabolismo
Si ritiene che le prime cellule siano state organismi simili a b. che vivevano in un ambiente ricco di molecole organiche fortemente ridotte, formate da processi geochimici nel corso di centinaia di milioni di anni. Esse ricavavano la maggior parte del loro ATP convertendo le molecole organiche ridotte in una varietà di acidi organici che venivano rilasciati come prodotti di rifiuto, acidificando l’ambiente. Le caratteristiche degli odierni b. anaerobi fanno pensare che l’acidificazione dell’ambiente causata dalle fermentazioni, i cui prodotti sono gli acidi lattico, succinico, formico e acetico, possa aver portato all’evoluzione delle prime pompe protoniche di membrana, che mantenevano un pH neutro all’interno della cellula. Tuttavia, poiché le molecole organiche preformate venivano ricostituite molto lentamente dai processi geochimici, la proliferazione di b. eterotrofi, che le usavano come fonte di carbonio e di potere riducente, non poteva continuare a lungo. La deplezione di sostanze organiche fermentabili portò presumibilmente all’evoluzione di b. autotrofi fotosintetici, che potevano usare CO2 come fonte di energia per produrre carboidrati, quali i b. verdi, i b. purpurei e i cianobatteri. Questi b. anche attualmente non sono dotati di cloroplasti ma posseggono membrane che compiono le reazioni alla luce della fotosintesi e utilizzano trasportatori di elettroni e pigmenti che assorbono la luce diversi da quelli delle piante. Fra questi, i b. verdi e i b. purpurei utilizzano come donatore di elettroni il solfuro di idrogeno e pertanto non producono ossigeno. Poiché gli elettroni rimossi da H2S hanno un potenziale ossidoriduttivo molto più negativo di quello dell’acqua, un fotone assorbito dal singolo fotosistema di questi b. è sufficiente a far raggiungere un potenziale ossidoriduttivo abbastanza alto da generare NADPH, mediante una catena di trasporto di elettroni piuttosto semplice. Il passaggio evolutivo successivo, avvenuto almeno 3 miliardi di anni fa, si è verificato con l’avvento dei cianobatteri, b. fotosintetici che usano l’acqua come fonte di elettroni. Essi hanno utilizzato entrambi i fotosistemi dei b. verdi e purpurei in un sistema di trasporto in serie di elettroni simile a quello delle piante superiori. Questi organismi avevano necessità chimiche minime e potevano quindi evolversi in modi preclusi ai b. fotosintetici precedenti; di conseguenza si accumularono sia sostanze organiche ridotte nel terreno sia ossigeno nell’atmosfera. Questo consentì lo sviluppo di un metabolismo aerobio efficiente: i componenti della catena di trasporto degli elettroni furono modificati per produrre citocromoossidasi, così che gli elettroni ottenuti da substrati organici e inorganici potessero essere trasportati all’ossigeno come accettore finale. Questi b. erano anche in grado di imbrigliare la grande quantità di energia rilasciata dalla demolizione dei carboidrati e di altre molecole organiche ridotte e di produrre anidride carbonica e acqua. Molti b. purpurei attuali possono passare dalla fotosintesi alla respirazione a seconda della disponibilità di luce e di ossigeno, per mezzo di piccole riorganizzazioni delle catene di trasporto degli elettroni. Man mano che i materiali organici si accumularono sulla Terra come risultato della fotosintesi, alcuni b. fotosintetici, compresi i precursori di Escherichia coli, persero la capacità di sopravvivere mediante la sola energia luminosa e cominciarono a basarsi interamente sulla respirazione.
Tra i b. eterotrofi, che utilizzano composti organici come fonte di energia, vi sono i b. saprofiti e i b. patogeni, che possono essere distinti in b. aerobi, quando richiedono l’ossigeno per la loro crescita, e b. anaerobi, quando sono inibiti o uccisi anche da basse concentrazioni di questo elemento. Tra questi due estremi si trovano specie la cui crescita è influenzata da un ampio spettro di differenti concentrazioni di ossigeno.
Riproduzione e crescita
I b. si riproducono per divisione della cellula madre in due cellule figlie (scissione diretta o schizogonia). La cellula batterica in procinto di dividersi aumenta di volume, poi comincia a restringersi in corrispondenza dell’asse mediano, fino a separarsi in due nuove entità. Queste possono restare in relazione, formando aggruppamenti caratteristici (catene, tetradi, filamenti, grappoli ecc.). L’intero processo ha una durata di 20-30 minuti.
Il tipo di crescita prevalente negli ambienti naturali è quello sessile. Quando l’apporto di nutrienti è limitato, i b. tendono ad aderire a supporti solidi restando così stabilmente all’interfaccia solido/liquido, dove si concentrano i nutrienti. Una volta adesi, i b. secernono sostanze esopolisaccaridiche che li circondano, garantendone la coesione al supporto e tra di loro. Si creano così i biofilm, che nella maggior parte dei casi sono polimicrobici. All’interno del biofilm, i b. crescono lentamente, formando microcolonie. Il biofilm viene detto maturo quando la crescita giunge al punto che le cellule più esterne si staccano, tornando alla vita planctonica e avviando poi la formazione di nuovi biofilm. L’intero processo impiega da alcuni giorni a qualche settimana.
Batteriologia
L’esistenza dei microrganismi è stata postulata fin dai tempi antichi, nel tentativo di spiegare numerosi fenomeni naturali, come per es. la decomposizione delle sostanze organiche, specialmente degli alimenti, la fermentazione lattica, acetica e alcolica, e inoltre il determinarsi delle malattie infettive, che suggerì ad antichi scrittori, come Lucrezio, il concetto di semi delle malattie (De rerum natura), e a G. Fracastoro (1546) l’idea di un contagium vivum come causa di malattia. Ma la verifica di tali concetti astratti è stata possibile solo in tempi relativamente recenti, quando il progresso nel campo dei sistemi ottici ha portato alla dimostrazione della esistenza dei microrganismi in maniera direttamente evidente ai sensi degli osservatori. La prima descrizione di forme batteriche risale a A. van Leeuwenhoek (1632-1723) che osservò (1676) in diversi materiali la presenza di minuscoli esseri capaci di movimento. In seguito i b. furono studiati dallo zoologo danese O.F. Müller, che ne descrisse i dettagli strutturali. Nella seconda metà del 19° sec. la batteriologia ebbe uno straordinario impulso da parte di studiosi quali L. Pasteur che ne individuò per primo i due fondamentali campi di azione, agrario e medico, e introdusse la coltivazione artificiale dei microbi, R. Koch, E. Behring, S.N. Vinogradskij, I.I. Mečnikov, P. Ehrlich e numerosi altri. In quel periodo fu chiarito il rapporto tra determinate forme batteriche e le malattie che esse possono provocare nell’uomo e negli animali; con la necessità di coltivare in vitro i b., allo scopo di poterne studiare la morfologia, le capacità fermentative e il potere patogeno, furono poste le basi della tecnica batteriologica.
Oggi si distingue la batteriologia generale, che inquadra le proprietà fondamentali della cellula batterica attraverso lo studio delle sue caratteristiche morfologiche e della sua fisiologia, e la batteriologia speciale, che studia i singoli gruppi di microrganismi, con particolare riguardo a quelli patogeni. La dimostrazione della presenza del microrganismo patogeno si può ottenere con mezzi diversi, a seconda delle caratteristiche dell’agente infettante e del materiale patologico su cui è condotta l’indagine, ossia con l’esame microscopico e colturale, con la tipizzazione fagica, con le tecniche di biologia molecolare, con la sierologia e le tecniche immunologiche.
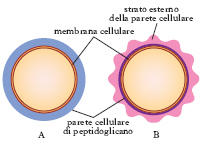
Batteriologia generale. - L’esame microscopico dei b. a fresco (b. ancora viventi) permette di studiare la forma, la disposizione reciproca, le dimensioni, la mobilità e la riproduzione dei b.; deve essere compiuto sempre in un mezzo liquido. Informazioni più dettagliate sulla morfologia e sulle strutture batteriche (presenza di flagelli, capsule, spore, granuli) provengono dall’osservazione di preparati microscopici colorati. Il più importante metodo di colorazione è rappresentato dalla colorazione di Gram. Con questa metodica, a causa delle differenze costitutive e strutturali della parete batterica, alcuni b. appaiono colorati in violetto ( b. gram-positivi; fig. 3 A), in quanto il decolorante utilizzato non riesce ad asportare il complesso cristalvioletto-iodio, mentre altri appaiono di colore rosso ( b. gram-negativi; fig. 3 B) in quanto, decolorati dall’alcol e dall’acetone, assumono il colore rosso del secondo colorante utilizzato. Con colorazioni specifiche si evidenziano altre strutture batteriche, quali le spore ( colorazione di Schaffer e Fulton con verde di malachite e safranina), la capsula (per es., con il metodo semplice dell’inchiostro di china), i flagelli (con una sospensione colloidale instabile di sali dell’acido tannico) ecc.
Scopo del microbiologo è allestire colonie pure, isolando i b. in esame. A tal fine si utilizzano terreni di coltura liquidi o solidi. La crescita dei b. è evidenziabile con l’intorbidamento del terreno. Si possono osservare inoltre agglutinazione, sedimentazione, produzione di gas. L’aggiunta di agar trasforma i terreni liquidi in semisolidi (0,3-0,5 % di agar) o solidi (1-2 % di agar). I terreni di coltura possono anche essere classificati in: naturali (contenenti patate, latte, malto, melassa ecc.); sintetici (con composizione chimica ben definita e composti da glucosio quale fonte di carboidrati, sali di ammonio quale fonte di azoto, fosfati quale fonte di fosforo, NaCl e sali minerali essenziali); semisintetici generici (con composizione chimica indefinita che sono i più usati, in quanto consentono la crescita di una vasta gamma di batteri); semisintetici specifici (in cui sono presenti sostanze utilizzabili per il riconoscimento e l’isolamento di batteri particolari). La crescita dei b. deve avvenire in condizioni ottimali di temperatura (che in genere per i batteri patogeni è intorno ai 37 °C), di O2 e di CO2, di umidità e di pH.
Con la metodica della tipizzazione fagica (➔ batteriofago) è possibile distinguere, nell’ambito della specie, tipi o ceppi di alcuni batteri, per es., stafilococchi, salmonelle, vibrioni.
Nuovi sistemi rapidi e precisi per il rilevamento e l’identificazione dei microrganismi presenti in un campione biologico sono stati allestiti grazie agli sviluppi della genetica molecolare negli 1990. Il campione viene fatto reagire con una sonda a DNA o RNA marcata radioattivamente (per es., con P32) o coniugata con un enzima cromogeno (per es., la fosfatasi alcalina). Se nel campione vi è un microrganismo con una sequenza di basi identica a quella della sonda, i due filamenti complementari si legheranno tra loro. Per evidenziare una quantità di b. molto piccola si usa la PCR (➔). Se la ricerca dell’antigene infettante, o delle sue tracce, non è realizzabile, si ricorre a una dimostrazione indiretta della sua presenza, studiando la risposta anticorpale dell’organismo nei suoi confronti.
Batteriologie speciali. - La batteriologia agraria studia l’incidenza e il ruolo dei b. nei processi agricoli e i metodi volti a combattere le fitopatologie. Tramite batteri ingegnerizzati è possibile introdurre nuovi geni nelle piante per migliorarne la produzione. Come biopesticida, si usa Bacillus thuringiensis che ha un effetto antilarvale.
La batteriologia alimentare si focalizza sulla prevenzione del deterioramento degli alimenti da parte di b. e della trasmissione di malattie di origine alimentare, come, per es., il botulismo e le salmonellosi. Si occupa inoltre della selezione di microrganismi per la produzione di alimenti quali formaggi, yogurt e altri derivati del latte. Negli ultimi anni si è studiato l’impiego di metodi di conservazione biologica attraverso i LAB (lactic acid bacteria) e/o i loro prodotti metabolici. Il procedimento più usato prevede l’acidificazione controllata dell’alimento attraverso la crescita dei LAB. Molte specie di b., che non sono in grado di sporulare, come strategia di sopravvivenza possono entrare nello stato di cellule dormienti (VNC, vitale non coltivabile); questo ha importanza dal punto di vista sanitario, perché lo stato VNC può essere indotto da molte delle condizioni che si verificano nel corso dei trattamenti per la conservazione degli alimenti. I b. VNC non vengono rilevati nel corso dei normali controlli microbiologici, ma possono tornare a uno stato normale una volta ingeriti.
In ambito industriale i b. sono utilizzati nell’allestimento di antibiotici, alcoli, farmaci e vaccini e nella depurazione ambientale dei rifiuti tossici.
Batteriodiagnosi
I metodi propri della batteriologia (isolamento del b., esame microscopico, coltura) consentono di accertare la presenza o l’assenza di b. patogeni in tessuti, secrezioni e liquidi corporei di individui malati, convalescenti o sani, e di identificarli. La batteriodiagnosi può essere eseguita in un malato, quando i dati clinici indirizzano verso una diagnosi che presuppone un determinato agente eziologico e il medico si avvale del laboratorio per una conferma, oppure in un convalescente, per accertare la presenza del b. che ha provocato l’infezione, o ancora in soggetti sani, per accertare la presenza di quei b. che possono costituire un potenziale pericolo per lo stesso soggetto o per la collettività. Le informazioni che si ottengono sull’identità dell’agente eziologico responsabile di una determinata infezione sono di particolare importanza sia per la prognosi sia per la scelta della terapia.
La diagnosi batteriologica mediante coltura in vitro, in terreni elettivi e selettivi, dell’agente patogeno a partire dai campioni clinici prelevati rappresenta in genere il metodo più specifico, anche se occorre tenere presente che molti b., quale, per es., Mycobacterium tuberculosis, hanno una crescita molto lenta e che per altri, quali, per es., Treponema pallidum o Mycobacterium leprae, non si conoscono le condizioni necessarie per coltivarli. Una tecnica largamente usata per l’identificazione finale dei b. dalle colture è la reazione di agglutinazione, basata sulla specifica interazione tra antigeni presenti sulle superfici batteriche e anticorpi noti. L’esame colturale è generalmente affiancato, oppure in alcuni casi sostituito, dall’esame microscopico a fresco o previa colorazione. Con l’esame microscopico a fresco, per es., si effettua facilmente la diagnosi di sifilide, osservando in campo oscuro, in campioni tessutali di lesioni primarie e secondarie, le spirochete dotate di forme e movimenti ondulatori caratteristici. L’esame microscopico previa colorazione mette in evidenza, oltre alla forma e alla disposizione spaziale delle cellule batteriche, anche eventuali strutture, appendici e granulazioni utili per il riconoscimento. Per es., la presenza nel liquido cefalorachidiano di soggetti con sospetta meningite cerebrospinale di diplococchi, che hanno le caratteristiche tintoriali dei b. gram-negativi, acquisisce un valore diagnostico e indica un’infezione da Neisseria meningitidis. La presenza di b. alcol-acido resistenti, osservabile in strisci di espettorato bronchiale o in tessuti normalmente sterili, costituisce invece un indizio d’infezione da Mycobacterium tuberculosis. L’impiego di anticorpi coniugati con sostanze fluorescenti consente di identificare, con il microscopio a fluorescenza, b. patogeni, anche in presenza di una popolazione multimicrobica nei materiali clinici.
Negli anni 1990, oltre ai tradizionali metodi colturali e microscopici utilizzati per la batteriodiagnosi, si sono sviluppati altri metodi che individuano gli antigeni o la sequenza degli acidi nucleici nei batteri di campioni clinici. Tali metodi presentano numerosi vantaggi, in quanto sono molto specifici, sensibili e rapidi e consentono di ottenere una diagnosi dell’infezione entro poche ore anziché in alcuni giorni. Per rilevare la presenza, pur se in tracce, di antigeni specifici nei materiali patologici, anche in assenza di batteri vivi, sono stati messi a punto metodi immunoenzimatici, metodi radioimmunologici e metodi di agglutinazione indiretta che si avvalgono, per il riconoscimento dei b. patogeni, dell’estrema specificità offerta dagli anticorpi monoclonali. L’agglutinazione indiretta prevede l’uso di biglie di lattice ricoperte da anticorpi per la cattura degli antigeni batterici e viene usata, per es., per identificare nel liquido cefalorachidiano materiali della capsula del meningococco e dello pneumococco, allo scopo di effettuare una diagnosi precoce di meningite. L’individuazione di sequenze significative del genoma batterico nei materiali patologici prevede, invece, l’uso di sonde che riconoscono le sequenze omologhe del genoma presente nei campioni, in prove di ibridazione condotte con metodiche diverse. Tra le infezioni batteriche più indicate per questo tipo di diagnosi diretta vi sono, per es., quelle causate da b. che crescono difficilmente in coltura, come i micoplasmi, responsabili di infezioni respiratorie, o da b. intracellulari obbligati trasmessi sessualmente come Chlamydia trachomatis, oppure da b. intracellulari facoltativi come Legionella pneumophila, responsabile di forme gravissime di polmoniti. In alcuni casi, la quantità di acido nucleico del batterio è talmente esigua che occorre amplificare un segmento del genoma batterico con una reazione a catena della polimerasi (➔ PCR); questa tecnica può rappresentare talvolta l’unico metodo per identificare b. che sfuggono a tutti gli altri metodi di indagine più tradizionali.