terapia
Studio e attuazione concreta dei mezzi e dei metodi per combattere le malattie.
Botanica
La t. vegetale (o fitoterapia) studia i rimedi, la loro somministrazione e la loro azione sulle piante e sugli eventuali loro parassiti. La t. in senso stretto cura le malattie già in atto, e può essere esterna (esoterapia) o interna (endoterapia), quest’ultima applicata soprattutto per curare carenze edafiche mediante la somministrazione di sostanze idrosolubili. Notevole importanza ha la t. preventiva o profilattica per impedire lo sviluppo di parassiti. Un ramo della t. è la chirurgia vegetale, solitamente applicata su esemplari arborei, che consiste nell’asportare e distruggere eventualmente con il fuoco le parti malate.
Medicina
T. genica
Definizione
L’espressione t. genica è stata originariamente proposta per indicare il trattamento di malattie ereditarie consistente nel sostituire un gene difettoso dal punto di vista funzionale con uno normale. Tentativi sperimentali di applicazione della t. genica in diverse aree biomediche (per es., oncologia e infettivologia) hanno portato alla ridefinizione e all’espansione del termine, che ora indica tutti i trattamenti che determinano alterazioni genetiche delle cellule.
I primi esperimenti di t. genica, iniziati nel 1990, sono stati effettuati su pazienti affetti da una forma, molto rara, di immunodeficienza congenita (SCID) dovuta a carenza dell’enzima adenosindeaminasi (ADA). Nei linfociti T prelevati dai pazienti è stato inserito il gene normale che codifica l’ADA assente o alterata; successivamente i linfociti T, così manipolati in vitro, sono stati reinoculati nei pazienti. Il successo degli esperimenti clinici di t. genica ha aperto la strada a una serie di ulteriori esperimenti che tentano di utilizzare il metodo di addizione genica per curare le malattie ereditarie e i tumori.
T. genica nelle malattie ereditarie
Le ricerche si sono essenzialmente rivolte alla cura della fibrosi cistica (➔ mucoviscidosi), della distrofia muscolare e delle malattie epatiche quali la fenilchetonuria e la ipercolesterolemia familiare. Anche se le ricerche non hanno portato a risultati apprezzabili per la cura di malattie ereditarie umane, molto si è appreso, anche dagli esperimenti non riusciti, sui metodi di trasferimento genico nelle cellule umane, su come ottenere una espressione continua ed efficiente dei geni trasferiti in vivo e su come affrontare i problemi riguardanti un organismo, certamente diversi rispetto a quelli che riguardano cellule in coltura. Durante gli studi per la t. genica della distrofia muscolare di Duchenne, per es., a causa delle grandi dimensioni del gene non è stato possibile trovare un vettore adatto per il suo trasferimento nelle cellule muscolari. Nella seconda metà degli anni 1990, tuttavia, sono stati costruiti e sperimentati vettori derivati da adenovirus privi di geni virali, in grado di veicolare fino a 28 kilobasi di DNA estraneo. In questo vettore è stato inserito un minigene, privo di introni, contenente le sequenze codificanti la distrofina, la proteina alterata negli individui affetti da distrofia di Duchenne. In topi knock out il minigene è in grado di esprimere elevati livelli di distrofina umana. È allo studio anche un altro vettore molto promettente che potrà essere utilizzato per diversi casi di t. genica, il cromosoma artificiale umano o HAC (human artificial chromosome; ➔ microcromosoma).
T. genica nei tumori
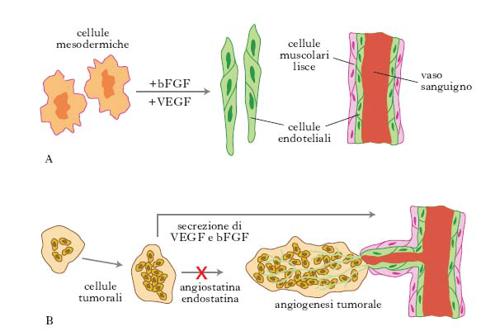
Nella t. genica dei tumori sono di grande interesse alcuni approcci sperimentali, quali, per es., l’inibizione dell’angiogenesi, l’attivazione del sistema immunitario, l’utilizzazione di geni suicidi o di antisenso. Gli esperimenti relativi all’inibizione dell’angiogenesi si basano sull’idea che per bloccare la crescita neoplastica bisogna impedire la crescita dei vasi sanguigni nella massa tumorale, togliendo così al tumore la possibilità di nutrimento (fig. 1). L’ipotesi è stata formulata dall’oncologo statunitense J. Folkman negli anni 1970 ed è stata ripresa in considerazione alla fine degli anni 1990. È noto che il tumore, una volta raggiunta una massa critica, stimola la crescita di nuovi vasi che permettono la sua ulteriore crescita. Le cellule tumorali infatti hanno la capacità di secernere alcuni fattori, quali il bFGF (basic fibroblast growth factor), e il VEGF (vascular-endothelial growth factor), che attivano la proliferazione delle cellule endoteliali delle pareti dei vasi (➔ angiogenesi). Sono state identificate due molecole, l’angiostatina e l’endostatina, prodotte dall’organismo, in grado di bloccare la crescita delle cellule endoteliali dei vasi e che potrebbero avere grandi potenzialità per bloccare la crescita tumorale.
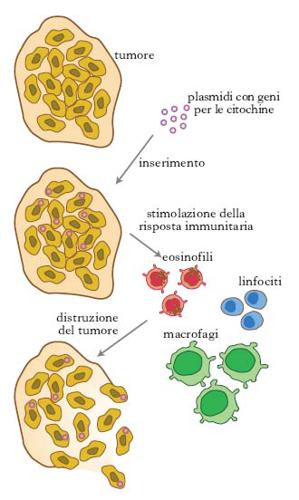
La proliferazione neoplastica si verifica quando la sorveglianza immunitaria viene elusa da determinate caratteristiche delle cellule tumorali, e tutte le t. basate sulla cosiddetta sorveglianza immunologica fanno in modo di stimolare il sistema immunitario affinché reagisca contro i tumori (➔ immunoterapia). Una t. genica su base immunologica si fonda sull’ipotesi che, anche modificando geneticamente solo poche cellule, il sistema immunitario sia in grado di amplificare la risposta. Vengono a tale scopo introdotti nelle cellule tumorali geni che codificano le citochine, molecole che stimolano la risposta immunitaria. Le cellule tumorali così trasformate richiamano linfociti, macrofagi ed eosinofili (fig. 2).
Alcune strategie di t. genica si basano sul principio di inserire geni tossici specifici per le cellule tumorali che non uccidono le cellule normali. Tra questi il più usato è quello che codifica la timidinachinasi (TK) del virus herpes simplex. TK è un enzima che fosforila la timidina formando la timidina trifosfato, il normale precursore degli acidi nucleici. La TK del virus ha la peculiarità di fosforilare anche analoghi della timidina che provocano gravi alterazioni al DNA al momento della sua sintesi. Si possono indurre le cellule tumorali a ‘suicidarsi’ inserendo in esse il gene per la timidinachinasi virale e somministrando poi il gancyclovir, un analogo alla timidina. Nelle cellule tumorali il gancyclovir fosforilato (TP-GCV o triphosphate-GCV) inibisce la DNA-polimerasi e quindi la sintesi del DNA, causando la morte della cellula proliferante (fig. 3).
Una nuova tecnica permette di costruire RNA od oligonucleotidi antisenso (AS) per regolare l’espressione dei geni. Il metodo dell’RNA antisenso implica la sintesi di molecole di RNA complementari a quelle di RNAm prodotte dalla trascrizione di un dato gene. Il normale RNAm di un gene, trascritto da uno dei due filamenti di DNA, si definisce di senso in quanto contiene una sequenza di codoni che sono letti durante la traduzione per produrre la sequenza di amminoacidi specifica del prodotto peptidico. Il filamento complementare dell’RNA di senso, detto antisenso, non contiene né le sequenze di codoni né le sequenze regolative necessarie per la traduzione di proteine. Nella cellula dove viene inserito, l’RNA antisenso ibridizza con molecole di RNAm dello stesso gene formando molecole di RNA a doppia elica che non possono essere tradotte in proteine. Un antisenso viene considerato quindi un agente terapeutico in quanto blocca la traduzione di proteine non desiderate. Nella fig. 4 viene rappresentata schematicamente la costruzione di RNA antisenso e di oligonucleotidi antisenso. Un cDNA viene clonato in un vettore di espressione nell’orientamento inverso che viene poi inserito in una cellula dove è sintetizzato l’RNA antisenso. Con questo metodo sono stati costruiti RNA antisenso per il fattore di crescita insulino-simile 1 e per il recettore dello stesso fattore di crescita.
T. intensiva
Per t. intensiva si intende l’insieme delle complesse procedure diagnostiche e terapeutiche finalizzate in ambito ospedaliero al ripristino e al sostegno di funzioni vitali (cardiocircolatoria, respiratoria, neurologica, metabolica) acutamente e gravemente compromesse (➔ rianimatologia). Per l’ottimale funzionamento delle unità di t. intensiva e per la migliore gestione possibile delle risorse di elevata complessità e costo che esse richiedono è necessario rispettare alcuni requisiti fondamentali: possibilità di far convergere competenze multidisciplinari sul malato critico; disponibilità immediata e continuativa dei servizi diagnostici; collegamento funzionale dell’area intensiva con tutti i reparti e i servizi dell’ospedale che devono interagire con essa (pronto soccorso, reparto operatorio, laboratori, radiodiagnostica, centro trasfusionale). Si possono distinguere i centri di rianimazione polivalenti, ormai presenti in quasi tutti gli ospedali e che trattano qualsiasi patologia critica, dalle t. intensive specialistiche, rivolte alla cura di pazienti omogenei per patologia o per fasce di età. Si possono, pertanto, identificare molteplici t. intensive: postoperatoria, per grandi ustionati, unità di t. intensiva coronarica, cardiochirurgica, neurochirurgica, neonatale.
Nell’ambito dell’organizzazione dei centri di rianimazione polivalenti e delle unità di t. intensiva specialistiche si possono distinguere strutture di primo livello e di secondo livello. Le strutture di primo livello sono collocate in ospedali e devono essere in grado di garantire il supporto delle diverse funzioni d’organo (ventilazione meccanica, trattamento dialitico, assistenza meccanica del circolo ecc.) e di permettere monitoraggi sofisticati (monitoraggio della pressione intracranica, della portata cardiaca ecc.). Le strutture di secondo livello sono, in genere, inserite in ospedali più piccoli, laddove è possibile garantire il trattamento di pazienti con una singola insufficienza d’organo.