recettore
In biologia e in medicina, qualsiasi struttura capace di reagire a sollecitazioni specifiche, sviluppando una reazione caratteristica. In immunologia, struttura di membrana in grado di reagire con l’antigene (➔ immunità).
Il termine, usato con significati differenti da P. Ehrlich nell’interpretazione dei fenomeni immunitari e da C.S. Sherrington in neurofisiologia, ha trovato ampia applicazione in fisiologia, in endocrinologia, in farmacologia, in biocibernetica, in microbiologia e in biochimica con riferimento a substrati di differente complessità, come enzimi, strutture molecolari, organuli subcellulari, corpuscoli pluricellulari.
Biologia
Estensione del concetto di recettore
Gli sviluppi della biochimica e della biologia molecolare hanno portato a estendere il concetto di r. a tutte quelle strutture molecolari mediante le quali le cellule comunicano fra loro per regolare lo sviluppo, per controllare l’accrescimento, per coordinare le funzioni. Queste strutture proteiche sono capaci di riconoscere molecole come gli ormoni, gli antigeni, i neurotrasmettitori, le immunoglobuline, le tossine batteriche, i virus, i farmaci e combinarsi con loro. L’estensione del concetto di r. a queste strutture molecolari ha consentito di spiegare il riconoscimento degli ormoni da parte dei bersagli cellulari, gli effetti eccitatori o inibitori di una stessa sostanza (per es., della noradrenalina sulle sinapsi adrenergiche postgangliari) e molti fenomeni fisiologici, come la tachicardia in risposta alla somministrazione intravenosa di liquidi (riflesso di Bainbridge), la regolazione dell’osmolarità a opera dei r. dei nuclei sopraottico e paraventricolare dell’ipotalamo in seguito alla diminuzione del volume del liquido interstiziale e delle concomitanti variazioni di concentrazione degli ioni sodio, la regolazione del volume extracellulare mediante lo stiramento delle pareti vascolari (degli atri, delle grosse vene, dell’aorta, delle carotidi).
Nella maggior parte dei casi le cellule dei Metazoi comunicano fra loro mediante segnali che agiscono a distanza. I segnali sono sostanze chimiche idrosolubili o liposolubili, proteiche e non proteiche e, a seconda della distanza alla quale agiscono, sono distinti in tre tipi: sinaptici, paracrini, ed endocrini. I segnali sinaptici, chiamati anche neurotrasmettitori, agiscono nello spazio sinaptico (dell’ordine di 30 nm) a livello della membrana postsinaptica. I segnali paracrini sono detti anche mediatori localizzati perché agiscono entro distanze di circa 1 mm. I segnali endocrini o ormonali sono trasportati dal sangue e agiscono su bersagli posti anche molto lontano dal tessuto in cui sono stati prodotti. Qualunque sia il tipo di segnale extracellulare, la cellula bersaglio risponde sempre per mezzo di r. situati sulla superficie della cellula o nel citoplasma.
I r. sono proteine o complessi proteici capaci di riconoscere e legare la sostanza segnale in modo altamente specifico, esternamente alla cellula, e dare inizio a una risposta caratteristica. Viceversa, gli ormoni steroidei attraversano per diffusione la membrana e, una volta dentro la cellula, si legano a un r. proteico citoplasmatico o nucleare. Questi r. endocellulari sono modificati dal legame con l’ormone in modo da esporre sulla loro struttura proteica dei siti di legame per sequenze specifiche del DNA, di cui viene attivata la trascrizione.
La superficie della cellula può contenere centinaia o migliaia di singole molecole di r.: per es., i r. per i diversi ormoni peptidici possono essere presenti in numero variabile da 500 a 100.000 per cellula. Normalmente, per ciascun tipo di molecola segnale, possono esservi tra 10.000 e 20.000 r. per cellula. I diversi tipi di cellule contengono combinazioni differenti di r., permettendo alle cellule di reagire selettivamente soltanto ad alcune molecole presenti nel gran numero di ormoni e di neurotrasmettitori che circolano nel sangue e nei liquidi extracellulari: per es., nei linfociti sono stati identificati circa 80 diversi tipi di recettori. La quantità e la qualità dei r. di membrana espressi in ciascun tipo cellulare non sono costanti ma soggetti a modificazioni durante lo sviluppo e la vita delle cellule.
Una parte delle alterazioni che distinguono una cellula tumorale da una normale può essere ascritta a modificazioni a carico dei r., così come alcune patologie (diabete, ipercolesterolemie) trovano la loro origine molecolare in difetti nella struttura e nella funzione di specifici sistemi recettoriali. Vi sono alcune caratteristiche comuni tra i vari r. e le diverse molecole segnale (dette genericamente ligandi): l’affinità tra r. e specifico ligando è molto elevata, essendo compresa tra 10–9 e 10–11 M; come già detto, tranne che per gli ormoni steroidei e per alcuni fattori di crescita, la molecola segnale non ha bisogno di entrare nella cellula per indurne una risposta mirata, ma è sufficiente il legame del ligando al suo r. sulla membrana cellulare esterna; inoltre, non si ha alcuna risposta da parte della cellula se il ligando viene artificialmente iniettato direttamente nel citoplasma; infine, se si escludono i meccanismi di internalizzazione del complesso ligando-r., il r. rimane in posizione nella membrana plasmatica durante l’induzione della risposta.
R. proteici di membrana
I r. proteici di membrana si possono suddividere in tre gruppi, a seconda del meccanismo di trasduzione del segnale usato: r. catalitici, r. legati alle proteine G e r. canale.
R. catalitici
I r. catalitici si chiamano così perché quando si legano a un messaggero specifico vengono attivati e operano cataliticamente come gli enzimi. Quasi tutti i r. catalitici conosciuti sono proteine transmembrana e hanno attività tirosinchinasica. Fa eccezione il r. per il fattore natriuretico atriale (➔ natriemia) che si lega a un r. dotato di attività guanilatociclasica, in grado cioè di trasformare il GTP in GMPc. Quest’ultimo è responsabile della successiva attivazione di una specifica proteinchinasi G, similmente all’AMPc. La parte polipeptidica che sporge dalla superficie esterna della membrana cellulare ha un sito di legame per il segnale, mentre la parte che sporge nel citoplasma ha attività chinasica. Quando la sostanza messaggero si lega allo specifico sito sul r., la parte interna del r. stesso subisce modificazioni conformazionali che rendono il sito enzimatico cataliticamente attivo, cosicché un gruppo fosforico dell’ATP viene trasferito al gruppo ossidrilico di specifici residui amminoacidici di tirosina di una o più proteine, che vengono a loro volta attivate.
A questa famiglia di r. appartengono quello per l’insulina e il r. per diversi fattori di accrescimento come l’EGF (epidermal growth factor) e il PDGF (platelet-derived growth factor). Alcuni oncogeni contengono r. catalitici abnormi con attività tirosinchinasica costitutiva, per cui sono capaci di codificare proteine molto simili ai fattori di accrescimento, stimolando così la proliferazione incontrollata delle cellule.
R. legati alle proteine G
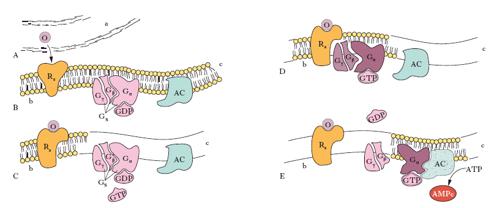
I r. legati alle proteine G sono così chiamati perché il legame primo messaggero-r. provoca l’interazione di tale complesso con una proteina polimerica, detta, appunto, proteina G. La sequenza di eventi che segue il legame del ligando a questo tipo di r. può essere così schematizzata: il r. lega il ligando alla superficie della membrana, subendo delle modificazioni conformazionali che espongono siti d’attacco del r. alla sub-unità α della proteina G; il r. interagisce con le altre due subunità, β e γ, della proteina G, consentendo alla sua subunità α di scambiare GDP con GTP. Questo provoca il distacco dal r. della proteina G che perde la sua subunità α, ora in grado di legarsi all’adenilatociclasi che, attivata, trasforma l’ATP in AMPc. L’attività fosfatasica della subunità α trasforma il GTP in GDP che si lega di nuovo alla subunità α, restituendole la conformazione necessaria per provocare la riassociazione con le subunità β e γ della proteina G, che è così pronta per una nuova interazione con il r. (v. fig.). Gli eventi successivi alla produzione di AMPc da parte dell’adenilatociclasi portano all’attivazione di specifiche proteinchinasi (proteinchinasi A) che fosforilano, attivandoli o inibendoli, enzimi regolatori di particolari vie metaboliche, proteine trasportatrici di membrana, proteine ribosomiali, proteine regolatrici dell’attività genica, r. stessi.
Questo tipo di meccanismo è osservabile per numerosi ormoni, quali adrenocorticotropo, luteinizzante, follicolo-stimolante, tireotropina ecc. Alcuni ligandi (vasopressina, angiotensina, adrenalina ecc.) per specifici r. provocano una risposta mediata dalle proteine G, che trasduce il segnale con meccanismi diversi da quelli sopradescritti. Infatti può avvenire che il complesso ligando-r.-proteina G sia in grado di interagire e attivare l’enzima fosfolipasi C, che trasforma il fosfatidilinositolo-4,5-difosfato in diacilglicerolo e inositolo-1,4,5-trifosfato. Il diacilglicerolo è responsabile dell’attivazione di specifiche proteinchinasi (proteinchinasi C), mentre l’inositolo-1,4,5-trifosfato provoca il rilascio di ioni Ca2+ dai siti di deposito intracellulare. L’attivazione della proteinchinasi C e l’aumento del calcio libero citoplasmatico stimolano l’attività catalitica di specifiche proteine, altrimenti inattive, provocando così la risposta metabolica cellulare allo stimolo recettoriale. Quindi, nei r. legati alle proteine G, l’AMPc, il diacilglicerolo, l’inositolo-1,4,5-trifosfato e il calcio citoplasmatico svolgono il ruolo di secondi messaggeri, dato che sono responsabili, direttamente o indirettamente, della risposta metabolica cellulare allo stimolo originariamente generato dall’interazione primo messaggero-recettore.
R. canale
I r. canale sono proteine trans-membrana adibite al passaggio di ioni dall’esterno all’interno delle cellule e viceversa. Queste proteine si legano a un certo numero di mediatori chimici e aprono o chiudono un canale ionico, modificando in tal modo transitoriamente la permeabilità della membrana agli ioni sodio e potassio e di conseguenza l’eccitabilità elettrica della cellula. Sono stati isolati e caratterizzati molti r. ionici o proteine canale di membrana: r. per l’adrenalina; r. per l’acetilcolina; r. per gli ioni sodio, potassio, calcio; r. di giunzione fra le cellule.
I r. per l’adrenalina, detti anche r. adrenergici, individuati in diversi tessuti e distretti dell’organismo, possono essere distinti in due gruppi principali: α e β. A seconda della localizzazione, essi vengono poi ulteriormente differenziati in α-1 (parete della maggior parte dei vasi della muscolatura liscia, muscolo dilatatore della pupilla, muscolo pilomotore, epatociti), α-2 (piastrine, cellule adipose, alcuni vasi della muscolatura liscia, r. adrenergici pre e post-sinaptici del sistema nervoso centrale), β-1 (cuore, sistema nervoso centrale, cellule adipose) e β-2 (vasi della muscolatura liscia, muscolature dell’utero e dei bronchi). Le azioni dovute alla stimolazione degli α-adrenergici sono: contrazione dei muscoli piloerettori, degli sfinteri, della milza e dell’utero, vasocostrizione in numerosi distretti vasali (a eccezione dei vasi dei muscoli scheletrici e del fegato), rilasciamento intestinale, dilatazione della pupilla. Le azioni legate alla stimolazione dei β-adrenergici sono: stimolazione cardiaca, contrazione degli sfinteri, rilasciamento dell’utero, dell’intestino e della muscolatura bronchiale, vasodilatazione a livello dei muscoli scheletrici e del fegato.
Storicamente, il primo r. studiato, e quello meglio conosciuto, è il r. per l’acetilcolina, che interviene nella trasmissione dell’impulso nervoso in corrispondenza delle sinapsi interneuroniche e neuromuscolari. Il r. per l’acetilcolina, che si libera dalle vescicole in corrispondenza della membrana presinaptica, trasforma il segnale chimico in un evento elettrico, cioè in una depolarizzazione localizzata della membrana postsinaptica, dove si trova localizzato il r. stesso. Si dice anche che il r. per l’acetilcolina è un canale attivato chimicamente: quando il mediatore si lega ai siti del r., si apre un poro permeabile agli ioni sodio e la membrana si depolarizza. Il processo di trasduzione può essere riassunto nelle seguenti tappe:
Il r. per l’acetilcolina è una grossa molecola glicoproteica (p. m. 268.000) formata da cinque subunità α2βδγ di peso molecolare da 40.000 a 65.000 ciascuna. I legami per l’acetilcolina si trovano sulle subunità α. Ogni r., perciò, lega due molecole di acetilcolina. Una volta isolato e purificato, questo r. è stato reinserito e ricostituito nella forma attiva nelle membrane lipidiche artificiali; in questo caso si è visto che quando l’acetilcolina si lega al r., la conduttanza del doppio strato lipidico agli ioni sodio aumenta esattamente come avviene nelle membrane naturali. È stato anche dimostrato che l’apertura del canale è dovuta a una modificazione conformazionale di porzioni peptidiche del r. proteico.
Nell’ambito dei meccanismi legati all’interazione ligando-r. alcuni polipeptidi ormonali (insulina, tireotropina) e alcuni fattori di crescita (EGF, PDGF), una volta legati al proprio r., sono trasportati nella cellula per endocitosi all’interno di speciali vescicole membranose, che, fondendosi tra loro, costituiscono vescicole di dimensioni maggiori, dette recettosomi. Nella cellula i r. e i ligandi seguono destini diversi: i r. possono essere ritrasportati sulla membrana cellulare, se le vescicole si fondono con l’apparato di Golgi; oppure, se le vescicole si fondono con i lisosomi, possono essere staccati dal ligando o degradati dagli enzimi idrolitici in essi presenti. Infine, se i ligandi si distaccano nel Golgi, si pensa possano giungere fino al nucleo ed esercitare direttamente un’attività sul DNA (ciò potrebbe spiegare gli effetti mitogeni dei fattori di crescita).
Molte sostanze, sia naturali sia farmacologiche, possono avere un diverso comportamento nei confronti di varirecettori. Infatti, alcune di queste presentano un’azione stimolante verso specifici r., che porta ad amplificare la risposta recettoriale; ne sono esempio gli alfa- e beta-stimolanti. Al contrario, altre sostanze, in particolare molti farmaci, hanno un’azione antagonista, quindi inibente, su vari r. bersaglio; esse si legano al r. non inducendo alcuna risposta e, soprattutto, rendendolo inaccessibile ai propriligandi. Tra questi antagonisti farmacologici, sono particolarmente utilizzate le sostanze alfa- e beta-bloccanti.
Medicina
In neurofisiologia, struttura morfologicamente ben definita, la cui reazione allo stimolo è un impulso nervoso. I r. sono distinti in: esterocettori, propriocettori e viscerocettori.
Gli esterocettori sono dislocati nella cute e in alcune mucose, ricevono stimoli provenienti dall’esterno, sono in rapporto alle sensibilità tattile e termica, alle sensazioni dolorifiche e comprendono tanto terminazioni nervose libere e reticoli plessiformi, quanto formazioni incapsulate; a queste ultime appartengono: i corpuscoli di Meissner e le terminazioni delle radici del pelo, per il tatto; le clavi terminali di Krause, per il freddo; i corpuscoli di Ruffini, per il caldo; quelli di Golgi-Mazzoni, per la pressione. Fra gli esterocettori, una categoria a parte è costituita dai telerecettori, che vengono attivati da stimoli che hanno la loro origine a distanza dall’organismo, come quelli acustici, visivi e olfattivi.
I propriocettori vengono stimolati da azioni del corpo stesso e sono localizzati nei canali semicircolari, nei muscoli, nelle fasce muscolari, nei tendini e nelle cartilagini articolari; comprendono le macule acustiche, i fusi neuromuscolari, gli organi tendinei di Golgi, i corpuscoli di Pacini e terminazioni nervose libere; sono in rapporto con il tono posturale, con il senso di posizione del corpo nello spazio e con la regolazione dei movimenti (senso muscolare).
I viscero;cettori sono distribuiti lungo le pareti dei visceri (apparato digerente, apparato urogenitale ecc.) e in quelle dei vasi: danno origine a riflessi viscerali e vascolari e, inoltre, a sensazioni coscienti di fame, sete, desiderio sessuale ecc.