insulina
Ormone ipoglicemizzante secreto dalle cellule delle isole di Langerhans del pancreas, isolato da F.G. Banting e C.H. Best nel 1921. Nel 1954 F. Sanger definì la struttura molecolare dell’i. di bue. L’i. è stata la prima proteina ottenuta per via sintetica; nel 1966 fu realizzata da P.G. Katsoyannis la sintesi dell’i. umana.
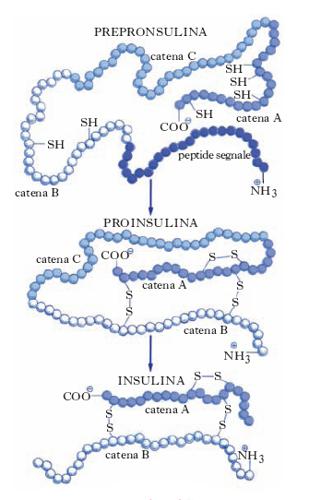
L’insulina è un polipeptide (peso molecolare vicino a 6000), costituito da due catene di amminoacidi A e B, unite fra loro da due ponti disolfuro -S-S-; un terzo ponte disolfuro congiunge due residui di cisteina della catena A.
L’insulinasi idrolizza le catene libere A e B che risultano formate rispettivamente da 21 e 30 residui amminoacidici. Nell’uomo, l’i. è sintetizzata dai ribosomi legati al reticolo endoplasmatico rugoso delle isole di Langerhans del pancreas come preproinsulina che contiene, alla sua estremità N-terminale, una sequenza segnale di 24 amminoacidi che garantisce l’ingresso all’interno del lume del reticolo endoplasmatico. Qui avviene la scissione proteolitica della sequenza segnale e la preproinsulina è trasformata in proinsulina. La proinsulina è trasportata all’esterno del reticolo endoplasmatico fino all’apparato del Golgi dove subisce una nuova degradazione proteolitica ed è trasformata in i., la quale viene immagazzinata in speciali granuli di deposito (fig. 1).
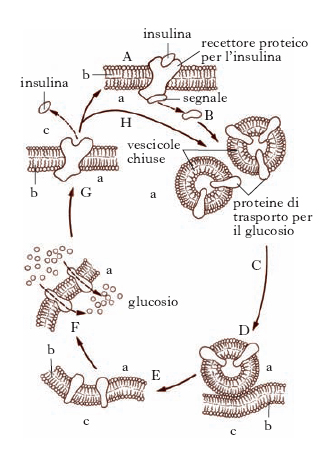
L’insulina forma cristalli solubili negli acidi e negli alcali diluiti. È secreta in funzione della concentrazione ematica del glucosio. Il meccanismo proposto, mediante il quale l’i. esplica la sua azione ipoglicemizzante, è riportato in fig. 2. Oltre ad agire indirettamente sulla velocità di trasporto del glucosio, l’i. influenza la glicogenogenesi, la sintesi lipidica nel fegato e nel tessuto adiposo. Nel diabete mellito funge da normalizzatore delle varie alterazioni metaboliche: la sua introduzione per via parenterale determina diminuzione della glicemia e scomparsa della glicosuria, favorisce l’accumulo del glicogeno nel fegato e completa la combustione dei grassi, eliminando lo stato di acidosi e la chetonuria. Un’azione antagonista rispetto a quella esercitata dall’i. è effettuata dal glucagone.
L’attività dell’i. è espressa in unità biologiche, basate sulla sua proprietà fondamentale di abbassare il tasso di glucosio del sangue; attualmente l’Unità internazionale di i. è definita come l’attività di 0,04167 mg del campione di i. adottato dall’Organizzazione mondiale della sanità.
Si dice insulinodipendente il diabete mellito con danno irreversibile delle isole di Langerhans e conseguente deficit di produzione di i., e quindi da curare con la somministrazione di questo ormone (diversamente dal diabete non-insulinodipendente, che insorge di solito nell’età matura o più avanzata). Insulinoresistenza è la refrattarietà, assoluta o relativa, all’i. di alcune forme di diabete mellito. Si ritiene che sia dovuta alla presenza di anticorpi per l’insulina. Nei pazienti che la presentano si utilizzano i. monocomponenti, cioè particolari preparazioni di i. altamente purificata, estratta dal maiale.