fattóre di créscita
fattóre di créscita Ciascun composto chimico prodotto dall’organismo, detto anche f. di accrescimento, in grado di stimolare la crescita e il differenziamento delle cellule. Presenti in piccolissime quantità, i f. di crescita sono difficili da isolare con le tecniche tradizionali usate per le proteine, ma le tecniche di isolamento e clonazione di geni, sviluppate negli anni 1980, hanno permesso grandi passi avanti in questo settore della biologia. I primi f. isolati sono stati il f. di crescita derivato dalle piastrine (PDGF, platelet derived growth factor) e il f. di crescita delle cellule nervose NGF (➔ neurotrofina). La tabella presenta i f. di crescita più importanti, mettendo in evidenza sia i capostipiti sia i membri della stessa famiglia successivamente isolati. Il PDGF, il f. di crescita dell’epidermide (EGF, Epidermal Growth Factor) e il fattore di crescita dell’insulina (IGF, Insulin Growth Factor), possono influenzare diversi tipi di cellule (f. a specificità larga), mentre altri, quali l’eritropoietina, agiscono solo su un tipo di cellule (f. a specificità stretta). I f. di crescita stimolano sia la proliferazione sia la crescita delle cellule, ma alcuni, per esempio l’NGF, promuovono solo la crescita dei neuroni; altri, come il f. di crescita trasformante beta (TGF-β, Transforming Growth Factorβ), a volte promuovono la proliferazione cellulare, a volte la inibiscono. Per esplicare la sua azione il f. si lega inizialmente a uno specifico recettore transmembrana, localizzato sulla superficie della cellula bersaglio; la porzione intracellulare del recettore catalizza poi la produzione di molecole che agiscono da segnali intracellulari trasmettendo lo stimolo ad altre molecole, di solito mediante una serie di fosforilazioni. Questi segnali, arrivati nel nucleo della cellula, determinano cambiamenti nella risposta dei geni.
I geni controllati dai f. di crescita sono di due categorie: geni della risposta precoce, quali i protoncogeni Myc, FOS e Jun, attivati entro 15 minuti dal trattamento delle cellule con il f. di crescita; e geni della risposta tardiva, indotti dopo circa un’ora. I geni di entrambe le classi non sono trascritti nelle cellule quiescenti, ma sono trascritti in grande quantità se si aggiungono f. di crescita nel terreno di coltura. Se l’esposizione ai f. di crescita viene mantenuta, il livello di espressione dei geni si riduce gradualmente. Nelle cellule in continua divisione i prodotti di questi geni sono sempre presenti, pur in basse concentrazioni. La trascrizione dei geni della risposta tardiva richiede i prodotti dei geni della risposta precoce; essi codificano alcuni componenti essenziali del sistema di controllo del ciclo cellulare, quali le proteine Cdk e numerose cicline coinvolte nell’indurre le cellule a superare i punti di regolazione del ciclo cellulare. Pur se non tutti i sistemi di controllo sono conosciuti, è noto che i segnali stimolatori agiscono superando dispositivi inibitori specifici che garantiscono il mantenimento della cellula in uno stato quiescente. I primi inibitori identificati sono state le proteine codificate dai geni antiproliferazione, scoperti originariamente come geni soppressori di tumore (per es., Rb). Con il progredire degli studi si delineano le funzioni dei f. di crescita riguardanti non solo la proliferazione e la crescita ma anche la sopravvivenza, la migrazione, lo sviluppo e il differenziamento delle cellule.
Abstract di approfondimento da Fattori di crescita di Andrea Levi e Atanasio Pandiella (Enciclopedia della Scienza e della Tecnica)
Gli organismi pluricellulari hanno la necessità di specificare il numero e le caratteristiche funzionali delle singole cellule che li compongono, di organizzarle in tessuti e organi e di orchestrare la loro funzione. Regolatori importanti di questi processi sono i fattori di crescita, che controllano i seguenti processi: (a) la sopravvivenza cellulare, tramite l’inibizione del processo di morte cellulare programmata detto ‘apoptosi’; (b) l’induzione della proliferazione o al contrario l’arresto del ciclo cellulare; (c) la riorganizzazione del citoscheletro con conseguente cambio di morfologia; (d) la modulazione dell’adesione tra cellula e cellula e tra cellula e matrice extracellulare; (e) il controllo della migrazione cellulare; (f) la regolazione dell’espressione genica con conseguente definizione del fenotipo differenziato.
I fattori di crescita, secreti nel mezzo extracellulare, possono agire sulla stessa cellula che li ha prodotti, e in questo caso si parla di un meccanismo d’azione autocrino, sulle cellule vicine, con meccanismo paracrino, oppure a distanza. Una volta raggiunta la cellula bersaglio i fattori di crescita si legano a uno o più tipi di recettori, esposti sulla superficie cellulare, con un’affinità che può variare anche di tre ordini di grandezza (in genere recettori a bassa affinità legano i fattori di crescita con una costante di legame nanomolare, e quelli ad alta affinità con una costante di legame picomolare). A seguito della formazione del complesso fattore di crescita-recettore sono generati all’interno della cellula bersaglio un numero limitato di ‘secondi messaggeri’, che a loro volta controllano una serie di vie biochimiche all’interno della cellula, regolando l’attività di enzimi e fattori di trascrizione.
La specificità della risposta cellulare a un determinato fattore di crescita dipende dall’opportuna combinazione dei segnali attivati dai secondi messaggeri. Se da una parte la stessa cellula risponde in modo diverso a differenti fattori di crescita, dall’altra lo stesso fattore di crescita induce risposte diverse in tipi cellulari distinti. Infine ci sono casi in cui fattori di crescita differenti inducono la stessa risposta nella stessa cellula. Considerando l’importanza dei fenomeni controllati dai fattori di crescita non sorprende che durante l’evoluzione si siano sviluppati vari meccanismi che regolano tutti i livelli della produzione e dell’azione dei fattori di crescita. In primo luogo sono modulate la loro sintesi e la loro maturazione (molti fattori di crescita sono sintetizzati sotto forma di un precursore inattivo, che deve essere processato per essere funzionale). Spesso ne è regolata la secrezione ed eventuali modificazioni covalenti condizionano la diffusione e la vita media dei fattori di crescita messi in circolo. Infine il legame con i recettori può essere regolato dalla funzione di proteine ‘carrier’, che trasportano i fattori di crescita all’interno della cellula, o da ligandi antagonisti che competono con essi per il sito di legame sul recettore. Occorre infine sottolineare che spesso i recettori per i fattori di crescita interagiscono fisicamente e/o funzionalmente con molecole di adesione alla matrice extracellulare quali le integrine o con molecole di adesione tra cellule quali le caderine.
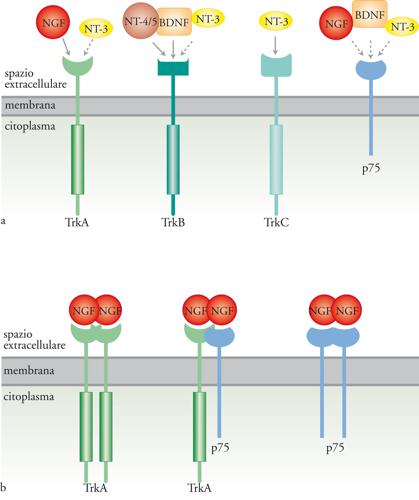
Le neurotrofine
Le neurotrofine sono una piccola famiglia di fattori che agiscono principalmente, ma non esclusivamente, sulle cellule nervose. Nei Mammiferi la famiglia è composta da quattro membri: NGF (Nerve growth factor), BDNF (Brain-derived neurotrophic factor), NT-3 (Neurotrofina 3) e NT-4/5 (Neurotrofina 4/5). L’NGF è stato il primo fattore di crescita descritto; è stato identificato nel 1951 da Rita Levi Montalcini e Victor Hamburger come una sostanza, rilasciata da un tumore (un sarcoma di topo), in grado di stimolare la crescita di cellule nervose del sistema simpatico e sensoriale dell’embrione di pollo. Durante lo sviluppo del sistema nervoso le neurotrofine hanno principalmente tre funzioni. In primo luogo sono fattori trofici, che permettono la sopravvivenza di cellule bersaglio. Cellule nervose immature, neurotrofina-dipendenti, competono tra loro per questi fattori, prodotti in quantità limitate dagli organi bersaglio. Ne consegue che i neuroni soprannumerari, che non riescono a legare una quantità sufficiente di neurotrofine, vanno incontro a morte cellulare programmata. In questo modo le neurotrofine partecipano alla formazione dei circuiti nervosi. Una seconda funzione delle neurotrofine è l’azione tropica, che determina la crescita delle fibre nervose nella direzione di maggiore concentrazione del fattore di crescita stesso. Infine, le neurotrofine esercitano una funzione differenziativa su alcune cellule immature modulandone il repertorio di geni espressi.
L’attività delle neurotrofine non è limitata al sistema nervoso immaturo; nell’organismo adulto le neurotrofine regolano la funzione di circuiti sinaptici già formati, modulando la risposta ai neurotrasmettitori. Da questo punto di vista la neurotrofina maggiormente studiata è il BDNF, che regola il processo noto come ‘potenziamento a lungo termine’ (Long term potentiation, o LTP). Il potenziamento a lungo termine è quel fenomeno che permette a una sinapsi stimolata ripetutamente in un breve intervallo di tempo di restare, per un certo periodo, più sensibile a una successiva stimolazione. Sembra che questo meccanismo contribuisca alla formazione della memoria. Le neurotrofine, inoltre, agiscono su cellule non neuronali: per esempio, modulano la motilità delle cellule di Schwann, cellule gliali che formano la guaina mielinica nel sistema nervoso periferico. È stato anche dimostrato che le neurotrofine hanno un effetto antiapoptotico su cellule del sistema immunitario, quali mastociti e linfociti B, e si suppone che esse regolino funzioni fisiologiche che necessitano di una risposta coordinata tra sistema nervoso e sistema immunitario.
Le neurotrofine, che nella forma attiva sono proteine di piccole dimensioni (ca. un centinaio di amminoacidi per un peso molecolare di poco maggiore a 10.000 Da) sono sintetizzate come precursori inattivi, pro-neurotrofine, processati tramite un taglio proteolitico a opera di proteasi specifiche presenti nelle vescicole di secrezione. Questo processo avviene con un’efficienza minore del 100% e come conseguenza sia pro-NGF che pro-BDNF possono essere rilasciati nello spazio extracellulare. La maturazione del pro-BDNF a opera di proteasi extracellulari quali la plasmina è un meccanismo che modula l’induzione dell’LTP. Il pro-NGF esercita una sua funzione indipendentemente dalla forma matura dell’NGF; in particolare il proNGF induce morte cellulare in sottopopolazioni neuronali che esprimono il recettore p75, un fenomeno che sembra rilevante nell’Alzheimer.
Esistono due tipi di recettori per le neurotrofine: p75, che appartiene alla famiglia dei recettori per il TNF (Tumor necrosis factor) e lega indistintamente tutte le neurotrofine con bassa affinità, e i recettori Trk, con attività tirosinchinasica (le tirosine-chinasi sono enzimi che aggiungono un gruppo fosfato ai residui di tirosina presenti nella sequenza di proteine substrato). I recettori Trk hanno per le neurotrofine un’affinità maggiore di p75 e sono tre: Trk-A che lega principalmente il NGF, e con minore affinità NT-3; Trk-B in grado di legare sia BDNF che NT-4/5; Trk-C che lega specificamente NT-3. Animali in cui i recettori Trk sono stati inattivati per knock out genico manifestano deficit durante lo sviluppo del sistema nervoso assai più gravi di quelli presenti in animali privati del recettore p75. Per questa ragione p75 è generalmente considerato un corecettore che modula l’affinità con cui le neurotrofine si legano al recettore Trk. Gli RNA messaggeri per i recettori Trk sono soggetti a processi di splicing alternativo, meccanismo per cui da un singolo gene originano più trascritti e di conseguenza diverse proteine. Si hanno così recettori varianti nella porzione extracellulare e, di conseguenza, con una differente affinità per le neurotrofine, e recettori che mancano della porzione intracellulare, con attività tirosinchinasica e quindi incapaci di generare una risposta biologica. Il legame delle neurotrofine ai recettori Trk induce la formazione di dimeri o multimeri degli stessi recettori e ne stimola l’attività tirosinchinasica. La fosforilazione dei residui di tirosina, nella porzione citoplasmatica del recettore, crea siti di legame ad alta affinità per una serie di molecole con varie attività enzimatiche o per proteine adattatrici, che a loro volta reclutano proteine in grado di trasdurre il segnale. In altre parole, si crea una piattaforma su cui si assembla la macchina molecolare di trasduzione del segnale. Le proteine reclutate in un determinato e specifico insieme sono alla base della specificità della risposta cellulare. L’analogia che viene spesso utilizzata è quella delle costruzioni fatte con i pezzi Lego (le tirosine fosforilate farebbero la funzione dei dentini nei mattoncini) che possono dare luogo a costruzioni di diverso tipo.
In cellule polarizzate e con morfologia complessa, quali le cellule nervose, i recettori possono non essere distribuiti in modo uniforme sulla superficie cellulare, e quindi la produzione di secondi messaggeri può essere localizzata in distretti specifici della cellula, con conseguenze importanti sulla risposta cellulare. Nel caso in cui le neurotrofine si leghino a recettori Trk presenti sulla membrana cellulare che circonda il corpo cellulare, la distanza tra la macchina di trasduzione del segnale e il nucleo è breve. Nel caso in cui le neurotrofine siano rilasciate dall’organo bersaglio e leghino recettori presenti sulla punta dell’assone, il segnale deve invece viaggiare per distanze grandi rispetto al diametro cellulare. In questo caso il complesso neurotrofine-recettori-molecole di trasduzione è internalizzato e trasportato in maniera retrograda dalla periferia verso il nucleo. Durante questo processo esistono ampi margini per modulare la risposta cellulare alterando l’assemblaggio delle proteine che trasducono il segnale. Le neurotrofine costituiscono un esempio di fattori di crescita che agiscono tramite recettori tirosina-chinasi. La lista dei fattori che utilizzano un meccanismo di trasduzione del segnale simile comprende anche la superfamiglia dell’EGF (Epidermal growth factor), costituita da 8 geni EGF-simili e dalle 4 neureguline; l’insulina e i fattori insulino-simili (IGF); i fattori angiogenetici della famiglia del VEGF (Vascular endothelial growth factor); i 23 componenti della famiglia dell’FGF (Fibroblast growth factor); le eferine, fattori di crescita ancorati alla membrana che mediano interazioni cellula-cellula e guidano la migrazione cellulare e la crescita direzionale dei prolungamenti nervosi.