Biologia dello sviluppo
Biologia dello sviluppo
Etimologicamente sviluppo significa 'uscire da un viluppo', cioè uscire da uno stato informe e acquisire una forma organizzata. In biologia, nella sua accezione più ristretta, il termine si riferisce allo sviluppo embrionale, il processo graduale attraverso cui l'uovo fecondato, o 'zigote', darà origine a un nuovo organismo; tuttavia, sono processi di sviluppo anche la metamorfosi e la rigenerazione, così come la continua produzione di cellule del sangue o dell'epidermide negli adulti. Nella storia delle discipline biologiche la biologia dello sviluppo discende dall'embriologia, i cui grandi problemi vengono riesaminati con i metodi che mano a mano divengono disponibili e grazie all'integrazione con molte altre discipline. L'interesse per il processo dello sviluppo embrionale è antico e per molti secoli l'embriologia ha descritto l'anatomia degli embrioni nelle loro diverse fasi (embriologia descrittiva).
Soltanto dalla fine del 1800 è iniziata un'effettiva sperimentazione sugli embrioni, volta a decifrare i meccanismi che ne guidano lo sviluppo (embriologia sperimentale), sebbene lo stesso Aristotele svolgesse con metodo scientifico un'analisi sperimentale tesa a scoprire qualche teoria generale su un aspetto del mondo naturale in divenire, l'embrione. Risulta che la denominazione Biologia dello Sviluppo sia stata introdotta per la prima volta nella corrispondenza tra Paul Weiss e Norman J. Berrill: Weiss scrisse a Berrill chiedendogli un nome per la scienza che includeva l'embriologia, ma anche l'attività dei geni, la rigenerazione, i movimenti cellulari e altre aree della developmental biology. Berrill si limitò a sostituire le lettere iniziali di developmental biology con le maiuscole: era così nata la Developmental Biology, in italiano Biologia dello Sviluppo.
Un'idea fondante la biologia dello sviluppo è che i processi di sviluppo siano governati da principî generali comuni, anche se questi possono non essere tutti rappresentati in un solo organismo. Perciò i biologi dello sviluppo utilizzano quegli organismi che meglio illustrano principî comuni: si tratta di un numero relativamente piccolo di animali o di piante, scelti perché convenienti da studiare e adatti alla manipolazione sperimentale e/o all'analisi genetica. Data la condivisione di principî comuni, la comprensione di un processo di sviluppo in un organismo può aiutare a capire processi simili in altri organismi, uomo incluso. Finora gli organismi modello principali comprendono, tra i Vertebrati, piccoli pesci come il medaka (Oryzias latipes) e il pesce zebra (Danio rerio), molto utili per l'esistenza di numerosissimi mutanti di sviluppo; la rana Xenopus laevis, per la continua disponibilità di centinaia di uova ed embrioni a sviluppo esterno, in cui è possibile combinare biochimica, microchirurgia e manipolazioni genetiche; il pollo, adatto a esperimenti di dissezione e ricombinazione di tessuti; il topo, di cui sono oggi disponibili centinaia di mutanti knock out (in cui sono abolite una o più funzioni geniche) o transgenici (che portano nel loro genoma un gene introdotto sperimentalmente); tra gli Invertebrati, il moscerino della frutta Drosophila melanogaster, grazie alla sua superba genetica; il nematode Caenorhabditis elegans, in cui è stata definita la genealogia di tutte le cellule a partire dall'uovo fecondato; gli echinodermi (riccio di mare, Echinus e Paracentrotus), che hanno favorito la comprensione dei meccanismi della fecondazione e dei primi stadi dello sviluppo. In un momento successivo è esplosa anche la biologia dello sviluppo delle piante, che negli ultimi anni ha rivelato aspetti importanti peculiari al loro sviluppo, utilizzando principalmente (ma non solo) la crocifera Arabidopsis thaliana. Della maggior parte degli organismi modello è nota l'intera sequenza del DNA genomico.
La biologia dello sviluppo
La biologia dello sviluppo è una disciplina biologica di sintesi che integra campi diversi della biologia come biochimica, biologia molecolare, fisiologia, biologia cellulare, genetica, anatomia, ricerca sul cancro, neurobiologia, immunologia, ecologia e biologia evolutiva. La sua data di nascita si colloca intorno ai primi anni Settanta del Novecento, quando si è iniziato a usare le nuove tecnologie del DNA ricombinante per spiegare come le istruzioni genetiche guidino la formazione di fenotipi composti da tipi cellulari e organi diversi. L'incorporazione di metodi genetico-molecolari negli studi sull'embrione ha così riavvicinato l'embriologia e la genetica, i cui concetti erano strettamente interconnessi nell'Ottocento e nei primi del Novecento ma che divennero tuttavia scienze separate intorno agli anni Venti, quando la genetica prese a occuparsi principalmente della trasmissione dei caratteri ereditari, mentre l'embriologia studiava come quei caratteri si esprimessero nei diversi fenotipi. La semplice osservazione che lo sviluppo si ripete a ogni generazione secondo il modello proprio di ciascuna specie fa capire che esso è un processo ereditario, e perciò i geni sono al centro dell'interesse della biologia dello sviluppo.
La rinnovata fusione tra genetica ed embriologia ha prodotto una straordinaria messe di nuove conoscenze e rappresenta un grande progetto nell'attuale biologia dello sviluppo. Inoltre questa, utilizzando nuovi metodi ‒ soprattutto biochimico-molecolari, cellulari e informatici, fino a quelli dell'attuale postgenomica ‒ si è espansa in campi che l'embriologia aveva abbandonato, come la morfogenesi, l'ecologia, la medicina, l'evoluzione. Riguardo alla medicina, identifichiamo nello sviluppo le cause di malformazioni ereditarie e cerchiamo le cure per le anomalie dello sviluppo. Questo settore include probabilmente i temi di più diffusa conoscenza pubblica, come le cellule staminali, la clonazione di organismi, l'ingegneria genetica, gli organismi transgenici, la fecondazione in vitro, le terapie per il cancro, la rigenerazione di organi, la senescenza e la durata della vita. In questi temi la capacità della biologia dello sviluppo di capire la natura, ma anche di trasformarla, ha rappresentato una vera rivoluzione, inimmaginabile solo dieci anni fa. Infine la biologia dello sviluppo, ponendo alla base dell'evoluzione anche i cambiamenti nell'espressione genica durante lo sviluppo, si è ricongiunta alla biologia evolutiva, come aveva previsto Stephen Jay Gould già nel 1977: "La comprensione dei meccanismi regolatori deve essere alla base del riavvicinamento della biologia molecolare a quella evolutiva: una sintesi delle due biologie avverrà sicuramente e, quando questo succederà, sarà sulla problematica dello sviluppo".
Lo sviluppo svolge due compiti fondamentali: dare origine a un organismo adulto a ogni generazione e assicurare la continuità della vita tra le generazioni. La biologia dello sviluppo si occupa di queste due questioni suddividendole in alcune domande principali.
Differenziamento. Una singola cellula, l'uovo fecondato, dà origine a centinaia di tipi cellulari diversi (per es., neuroni, globuli rossi, cellule muscolari, ecc.). Come può avvenire ciò?
Morfogenesi. Le cellule dell'embrione migrano, muoiono, si distribuiscono in foglietti separati, costruiscono la forma del corpo e di organi distinti. Come possono formarsi tali strutture ordinate nello spazio?
Accrescimento. La crescita del tutto e delle sue parti è strettamente regolata: ogni specie raggiunge una dimensione che le è propria, gli occhi cessano di accrescersi una volta raggiunto un volume definito. Come è regolata la proliferazione cellulare?
Riproduzione. L'uovo e lo spermatozoo sono cellule molto specializzate, le uniche capaci di trasmettere l'informazione genetica per la costruzione di un nuovo organismo da una generazione all'altra. Come vengono distinte dalle altre cellule per questo compito, essenziale alla continuità della vita?
Evoluzione. L'evoluzione coinvolge cambiamenti ereditari nello sviluppo. Come è possibile che i cambiamenti nello sviluppo creino nuove forme? Quali cambiamenti ereditari sono possibili? Esistono bias (tendenze preferenziali) dell'embrione verso cambiamenti definiti, che diano una direzione all'evoluzione?
Rapporto con l'ambiente. Lo sviluppo di molti organismi è influenzato da condizioni ambientali. In alcuni Rettili il sesso è determinato dalla temperatura cui le uova sono esposte; certe sostanze chimiche presenti nell'ambiente possono causare malformazioni. Come si integra lo sviluppo di un organismo con il suo ambiente?
Grazie all'integrazione di diverse discipline e dei loro metodi, la biologia dello sviluppo ha aperto campi ignoti e prodotto conoscenze di grande rilievo. Per citare solo alcuni esempi, ha chiarito come si stabiliscano gli assi corporei, ossia come l'embrione 'sappia' dove formare la testa e dove la coda, dove il dorso e dove il ventre; le basi molecolari del differenziamento cellulare; le basi essenziali della formazione di organi complessi come l'arto, l'occhio o il cervello. La rapida crescita della biologia dello sviluppo è testimoniata dalla proliferazione di testi e riviste di Developmental Biology in molti Paesi e dall'attribuzione del Premio Nobel per la medicina o fisiologia a scienziati che hanno chiarito quale sia il controllo genetico della specificazione degli assi corporei (1995) o la patogenesi di molte malattie legate allo sviluppo (2002).
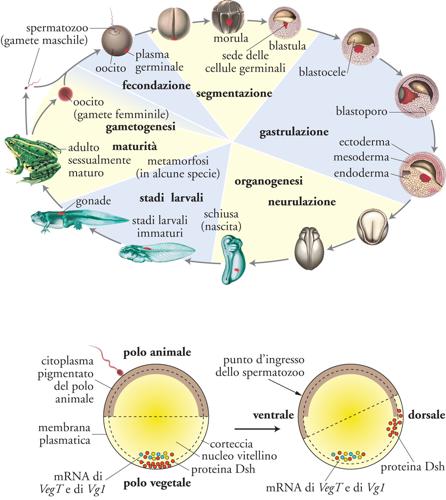
Lo sviluppo embrionale è parte integrante del ciclo vitale, che è la reale rappresentazione di un organismo. Anche se la vita è un processo ciclico, si può tuttavia individuare all'inizio di un nuovo ciclo la fecondazione, cioè la fusione del materiale genetico dello spermatozoo con quello dell'uovo. La fecondazione dà origine a un embrione formato da una sola cellula: l'uovo fecondato, o zigote. Segue l'embriogenesi, attraverso cui l'embrione moltiplica le proprie cellule, dà forma al proprio corpo, costruisce gli organi. Nel mondo animale esiste un’incredibile varietà di embrioni, ma per lo più questi attraversano le fasi dell’embriogenesi presentate nella Tav. I; in essa per chiarezza la descrizione si riferirà principalmente a Xenopus, anche se per molti aspetti può essere ritenuta generalizzabile.
Il processo differenziativo: l'eredità dell'embriologia
I blastomeri derivati dalla segmentazione differenziano progressivamente nella gran varietà di cellule e tessuti presenti negli adulti: neuroni, cellule muscolari, osteociti, cellule del sangue e così via. Molto ci si è interrogati, nella storia dell'embriologia prima e della biologia dello sviluppo poi, sui meccanismi che guidano il differenziamento cellulare. In sintesi, il processo differenziativo è guidato dal gioco interattivo tra meccanismi interni alla cellula e influenze che le giungono dall'esterno. L'embriologia ha definito 'a mosaico' lo sviluppo diretto principalmente da componenti interni ai singoli blastomeri, poiché l'embrione appare costituito da parti autonome, come le tessere di un mosaico. Oggi sappiamo che molecole di derivazione materna ‒ i determinanti citoplasmatici ‒ possono segregare con la segmentazione in modo asimmetrico tra i vari blastomeri, dirigendone il diverso destino. Con il raffinarsi della biochimica e della biologia molecolare sono stati identificati molti determinanti: questi sono spesso fattori di trascrizione, proteine che governano l'espressione di altri geni, innescando una cascata di attività genica che guida la genesi di un tessuto.
Al contrario, nello 'sviluppo regolativo' il differenziamento è diretto principalmente da segnali che giungono a ciascun blastomero dall'esterno (per es., interazioni cellula-cellula, molecole secrete da altri blastomeri, ecc.). Lo sviluppo a mosaico prevale in molti invertebrati, mentre lo sviluppo regolativo è presente in alcuni invertebrati e prevalente nei Vertebrati. Tuttavia, nessuno sviluppo è esclusivamente a mosaico o regolativo, ma nel proprio svolgimento spazio-temporale comporta in genere entrambe le modalità.
L'embriologia sperimentale ha sfruttato appieno la possibilità di saggiare se lo sviluppo di un organismo fosse a mosaico o regolativo, producendo esperimenti tra i più belli della sua storia. Lo studio di modalità di sviluppo di tipo regolativo ha messo in luce il fenomeno dell'induzione, in cui una cellula o un gruppo di cellule inviano segnali che influenzano il destino di altre cellule. L'induzione è di grande importanza sia nello sviluppo precoce sia nella formazione dei diversi organi: il primo caso individuato (1901) è l'induzione del cristallino da parte della vescicola ottica.
Come agiscono infine i determinanti o l'induzione? In ogni caso, l'azione di questi meccanismi differenziativi si esercita sul corredo genetico delle singole cellule. È da ascrivere alle conquiste della biologia dello sviluppo l'aver messo in luce il paradigma dell'espressione genica differenziale nello sviluppo, secondo cui è il cambiamento spazio-temporale dell'espressione genica a indirizzare le cellule verso vie diverse di differenziamento. Per esempio, geni che dirigono il differenziamento delle fibre muscolari sono attivi nello sviluppo di questo tipo cellulare e invece silenti nelle cellule a destino neuronale, e viceversa. È stato così spiegato in che modo le cellule che possiedono tutte (con poche eccezioni) lo stesso patrimonio genetico possano differenziarsi nei tipi cellulari più diversi. La comprensione delle vie che controllano il differenziamento cellulare e l'identificazione dei geni chiave su cui tali vie agiscono hanno implicazioni vaste e profonde sia per la conoscenza biologica di base sia per la nostra capacità di organizzare interventi a fini terapeutici.
3. Induzione primaria e induzione neurale
La formazione del sistema nervoso nei Vertebrati è un caso esemplificativo del processo di induzione. Fu Hans Spemann, all'inizio del secolo scorso, a dimostrare nei tritoni che il sistema nervoso non si forma autonomamente ma viene indotto, durante lo sviluppo, da segnali provenienti dal mesoderma dorsale. L'esperimento chiave, realizzato assieme alla sua collaboratrice Hilde Mangold, consistette nel trapianto del labbro dorsale del blastoporo ‒ il tessuto embrionale destinato a formare la notocorda ‒ da un embrione allo stadio di gastrula al lato ventrale di un secondo embrione ospite, allo stesso stadio.
In seguito al trapianto, sul lato ventrale dell'embrione ospite si formò un secondo asse dorsale, contrapposto all'asse embrionale primario: l'organismo risultante era dunque formato da due larve, unite per il ventre.
L'impiego di embrioni di due specie distinte di tritone, diversamente pigmentate, consentì a Spemann di ricostruire quale fosse la provenienza delle cellule dell'asse dorsale secondario. Mentre la notocorda si formava completamente a spese del trapianto, le rimanenti strutture dorsali (somiti e tubo neurale) derivavano in gran parte dai tessuti ventrali dell'ospite che, in assenza di trapianto, avrebbero dato origine ai derivati ventrali del mesoderma (per es., sangue) e dell'ectoderma (per es., epidermide del ventre). Spemann concluse che il frammento trapiantato induceva il cambiamento del destino differenziativo nei tessuti dell'ospite. Ritenendo, erroneamente, che gli eventi induttivi da lui osservati fossero i più precoci durante lo sviluppo, li indicò con l'espressione 'induzione primaria', che include l'induzione neurale. Inoltre, attribuì al labbro dorsale del blastoporo il nome di 'organizzatore' (in seguito denominato 'organizzatore di Spemann'), vista la sua straordinaria capacità di guidare la formazione dell'asse embrionale. Omologo all'organizzatore di Spemann è il nodo di Hensen, o semplicemente 'nodo', rispettivamente nei Sauropsidi o nei Mammiferi. Per la raffinata capacità sperimentale e per l'acume analitico e interpretativo, che avevano condotto alla scoperta dell'organizzatore e dell'induzione neurale, Spemann ottenne il Premio Nobel nel 1935.
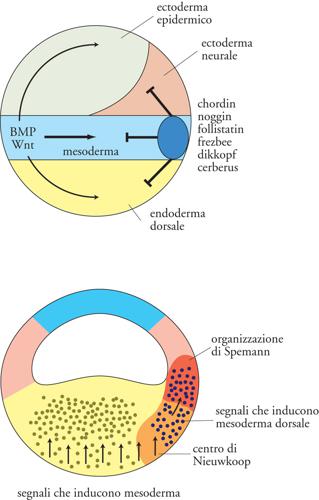
Nei decenni successivi alla scoperta di Spemann, un intenso lavoro di ricerca è stato rivolto all'identificazione dei fattori che mediano le attività dell'organizzatore, ma solo in anni recenti la clonazione molecolare ha permesso di isolare i geni e i prodotti responsabili dell'induzione neurale. Con sorpresa, si è trovato che non occorre tanto un segnale che neuralizzi l'ectoderma, quanto un segnale che contrasti un suo possibile destino epidermico (cioè non neurale; fig. 4 in alto). L'ectoderma produce infatti un segnale antineurale costituito principalmente dalle proteine BMP (Bone morphogenetic proteins), che agiscono su recettori posti sulla membrana cellulare. L'azione dei fattori BMP innesca, all'interno delle cellule bersaglio, una via di trasduzione del segnale che attiva la trascrizione di geni a effetto 'ventralizzante' (come, per es., i geni vent) che, nel caso del foglietto ectodermico, indirizzano le cellule verso il destino epidermico, prevenendone il destino neurale. Nello sviluppo embrionale, l'organizzatore attua l'induzione neurale contrastando l'azione dei BMP: durante la gastrulazione e la neurulazione vengono prodotte alcune proteine secrete (principalmente noggin, chordin e follistatin) che legano i BMP negli spazi extracellulari delle regioni dorsali dell'embrione, impedendone l'associazione con i propri recettori ed i conseguenti effetti antineuralizzanti. Ulteriori segnali induttivi in forma di altre molecole secrete, come FGF (Fibroblast growth factor), Wnt e acido retinoico, completano la regionalizzazione del neuroectoderma in senso antero-posteriore: tali segnali 'posteriorizzano' infatti il neuroectoderma inizialmente indotto come anteriore dagli inibitori di BMP. Questi risultati sono in accordo con il modello ormai classico di induzione neurale a due stadi (modello di 'attivazione e trasformazione'), formulato da Pieter Nieuwkoop all'inizio degli anni Cinquanta: tale modello si va evolvendo alla luce di nuove evidenze sperimentali.
Da un lato, è emerso che il mesoendoderma anteriore (placca precordale ed endoderma anteriore) gioca un ruolo importante a garanzia del corretto sviluppo delle regioni più rostrali del sistema nervoso, assicurando così la corretta formazione dell'encefalo. Questo tessuto produce infatti molecole che integrano l'azione degli inibitori di BMP, proteggendo le regioni neurali anteriori dall'azione dei fattori posteriorizzanti. Per esempio, le proteine dikkopf, frezbee e cerberus esercitano un'azione antagonista all'effetto posteriorizzante di Wnt (cerberus inibisce anche i fattori TGF-β nodal e i BMP), mentre fattori di crescita simili all'insulina (IGF, Insulin-like growth factors) svolgono un'azione neuralizzante in senso anteriore. D'altro canto, esperimenti recenti rivelano anche l'esistenza di altri fattori ‒ oltre chordin, noggin e follistatin ‒ in grado di neuralizzare l'ectoderma. Tra questi, la via di segnale di FGF reprime la cascata di trasduzione del segnale di BMP, potenziando così l'azione degli altri inibitori. Infine, anche la β-catenina ha un ruolo positivo nell'induzione neurale: una volta traslocata nei nuclei del lato dorsale della blastula di Xenopus, vi attiva transientemente i geni per chordin e noggin, sensibilizzando l'ectoderma dorsale all'induzione neurale già prima dell'inizio della gastrulazione.
In conclusione, la ricerca recente ha accresciuto la complessità del nostro modo di concepire l'induzione neurale, i cui eventi precoci inizierebbero prima di quanto ritenuto finora, precedendo l'avvio della gastrulazione. Inoltre, mentre il ruolo degli inibitori di BMP rimane centrale, recentemente altre vie di segnale (FGF, Wnt, IGF) hanno ricevuto maggiore attenzione anche in rapporto agli eventi più precoci dell'induzione neurale. È possibile che il meccanismo complessivo sia unitario e utilizzi le stesse vie molecolari, ma con importanza relativa diversa nei vari organismi modello.
In seguito ai fenomeni iniziali di induzione e regionalizzazione, lo sviluppo del sistema nervoso prosegue con il differenziamento cellulare, la costruzione delle varie aree morfo-funzionali e lo stabilirsi delle appropriate connessioni e reti neuronali che ne rendono possibile il funzionamento.
Induzione del mesoderma
Benché Spemann avesse definito 'induzione primaria' l'attività dell'organizzatore, è stato successivamente scoperto che l'organizzatore stesso viene indotto, assieme al restante mesoderma, prima dell'inizio della gastrulazione. Esperimenti classici di Nieuwkoop in embrioni di anfibi hanno dimostrato che la regione vegetativa (endoderma presuntivo) rilascia segnali che inducono un destino mesodermico nelle cellule della zona equatoriale della blastula. In particolare, le cellule vegetative ventrali inducono soprattutto mesoderma ventrale (mesotelio e sangue); invece, le cellule vegetative dorsali inducono mesoderma dorsale (notocorda e somiti) e, se trapiantate in posizione vegetativa ventrale, causano la formazione di un secondo organizzatore nella zona equatoriale sovrastante. Da queste evidenze sperimentali è derivato il concetto di centro di Nieuwkoop, un centro-segnale situato nel quadrante dorso-vegetativo in grado di indurre l'organizzatore di Spemann nella zona marginale dorsale (fig. 4 in basso). Il processo di induzione del mesoderma coinvolge molecole secrete delle classi FGF e TGF-β, materne e zigotiche: queste sono in grado di attivare, nelle cellule della zona marginale, geni chiave per il differenziamento mesodermico (per es., brachyury); all'opposto, il blocco delle loro vie di segnale comporta la mancata formazione del mesoderma.
In Xenopus, tra i determinanti materni vegetativi riveste un ruolo cruciale il fattore di trascrizione VegT che, dopo la transizione di medio-blastula, attiva nella regione vegetativa dello zigote l'espressione dei geni per le molecole secrete di tipo TGF-β o FGF. Fattori TGF-β agiscono, a concentrazione maggiore, anche sulle stesse cellule vegetative, inducendo un destino endodermico (sarebbe perciò più corretto parlare complessivamente di induzione meso-endodermica). Esiste quindi un gradiente morfogenetico di fattori induttivi dalla porzione vegetativa a quella più animale. Quest'ultima viene protetta dall'azione degli induttori di mesoderma a opera di un prodotto materno recentemente identificato (ectodermin), il cui mRNA è localizzato al polo animale dell'uovo: ectodermin agisce da inibitore dei TGF-β, indirizzando così le cellule più animali verso un destino ectodermico. Nei Mammiferi, è cruciale per la formazione del mesoderma il ruolo del fattore nodal (un TGF-β), che svolge le funzioni adempiute congiuntamente, in Xenopus, da vari fattori TGF-β: l'inattivazione di nodal provoca, nel topo, la completa assenza di mesoderma.
Alla funzione dei fattori di crescita sopra citati si sovrappone, nella regione dorsale dell'embrione di anfibio, l'azione della via canonica di Wnt/β-catenina di derivazione materna (fig. I.1in basso ), che contribuisce alla specificazione sia del centro di Nieuwkoop che dell'organizzatore. La β-catenina viene infatti traslocata nei nuclei delle cellule embrionali dorsali, dove può funzionare come fattore di trascrizione. Nel centro di Nieuwkoop la β-catenina appare rinforzare l'espressione e la produzione del fattore TGF-β Xnr. Inoltre, essa promuove anche l'espressione di geni chiave per la specificazione e l'azione dell'organizzatore di Spemann, quali siamois e goosecoid. L'attivazione di questa via di segnale conferisce dunque il carattere di 'organizzatore' al mesoderma dorsale, distinguendolo dal restante mesoderma. L'importanza di Wnt/β-catenina per la determinazione dell'asse embrionale è dimostrata anche in altri Vertebrati, come il pesce zebra e il topo.
Con la gastrulazione, l'organizzatore assume progressivamente la morfologia della notocorda e agisce sul mesoderma laterale a esso adiacente, inducendone la trasformazione in senso dorsale: originano così i somiti (aggregati metamerici e simmetrici di cellule da cui derivano il derma, la muscolatura scheletrica e le vertebre) e il mesoderma intermedio (dal quale deriva il sistema escretore): quest'ultimo è formato dai peduncoli che connettono i somiti al restante mesoderma laterale e ventrale, non metamerico (fig. I.2 in alto). La 'dorsalizzazione' del mesoderma laterale è mediata dalle stesse molecole secrete dall'organizzatore, che compiono l'induzione neurale (chordin e noggin): in questo caso esse contrastano l'azione ventralizzante di BMP nel foglietto mesodermico (fig. 4 in alto). Il loro effetto dorsalizzante può essere rivelato iniettando i corrispondenti RNA messaggeri sul lato ventrale dell'embrione di Xenopus: il risultato spettacolare di questo esperimento è quello di riprodurre ‒ con l'iniezione di una singola specie di mRNA ‒ gli effetti del trapianto dell'organizzatore, ovvero la formazione di un asse embrionale secondario in posizione ventrale.
Biologia evolutiva dello sviluppo
L'interazione tra le problematiche dello sviluppo embrionale e quelle dell'evoluzione è stata così proficua e intensa da generare ‒ nei primi anni Novanta ‒ una nuova disciplina, la 'biologia evoluzionistica dello sviluppo', o brevemente 'evo-devo' (da evolution e development). Alla base, vi è la scoperta che molti dei geni coinvolti nello sviluppo degli organismi animali sono evolutivamente conservati: si ritiene perciò che tali geni siano omologhi, cioè derivino da uno stesso gene ancestrale, presente in un progenitore comune alle specie considerate. Questo dato rappresenta una delle dimostrazioni più significative della discendenza comune degli organismi: geni che hanno un ruolo chiave nel generare la forma biologica operano dagli invertebrati ai Mammiferi.
Il caso più eclatante è probabilmente quello dei geni omeotici (HOM/Hox), che controllano le identità delle strutture lungo l'asse antero-posteriore nei Metazoi: dove fare le zampe o le ali, dove le braccia o le gambe e così via. Mutazioni nei geni omeotici causano cambiamenti nell'identità delle strutture: per esempio, in Drosophila una di queste mutazioni trasforma i bilanceri in ali, generando un anomalo dittero con quattro ali. Nonostante la distanza tra la mosca e il topo, una mutazione simile nel topo trasforma la prima vertebra lombare in una vertebra toracica, che come tale porta coste. Le mutazioni omeotiche rivelano quindi la profonda condivisione dei meccanismi genetico-molecolari che regolano lo sviluppo di organismi così diversi come la mosca e il topo.
Tale condivisione riguarda molti altri geni importanti nello sviluppo: geni omologhi ‒ orthodenticle (otd) in Drosophila, i geni Otx dei Mammiferi ‒ sono coinvolti perfino nella formazione delle strutture cefaliche degli Artropodi e dei Vertebrati. Le rispettive mutazioni producono profonde alterazioni nello sviluppo della testa in entrambi gli organismi. Le funzioni di questi geni sono così conservate che i geni Otx umani possono recuperare gli effetti della mutazione otd nel moscerino; reciprocamente, l'eliminazione di Otx2 nel topo viene compensata dal gene otd di Drosophila. Dunque, geni omologhi sono tra i responsabili della formazione del cervello nella mosca, nel topo e nell'uomo, nonostante le profonde differenze anatomo-funzionali. Anche geni che dirigono lo sviluppo dell'occhio in Vertebrati e invertebrati, come Pax6 nei Mammiferi e l'omologo eyeless/toy in Drosophila, sono estremamente conservati, nonostante le diverse morfologia, struttura, biochimica, origine embrionale dell'occhio dei Vertebrati, rispetto a quello di Drosophila o di altri invertebrati.
Se la conservazione dei sistemi genici di sviluppo riflette un'origine comune dei vari phyla, modificazioni di un progetto di sviluppo inizialmente condiviso possono aver causato profonde transizioni evolutive. Embriologi e anatomisti avevano proposto da lungo tempo che la parte occipitale del cranio fosse inizialmente comparsa negli Gnatostomi grazie alla fusione con il cranio di alcuni abbozzi vertebrali, corrispondenti ai somiti più rostrali. Le modalità genetico-molecolari alla base di questa transizione evolutiva sono rimaste a lungo sconosciute, fino a quando nel 1992 non è stato dimostrato che l'espressione ectopica del gene Hoxd4 nei somiti occipitali dell'embrione di topo, dove questo gene normalmente non è espresso, riporta parte della regione occipitale all'ancestrale morfologia vertebrale. L'interpretazione evolutiva di questo esperimento è che la scomparsa dell'espressione del gene Hoxd4 dai somiti occipitali abbia reso possibile l'assimilazione al cranio degli abbozzi vertebrali più anteriori, generando la regione occipitale. Modificazioni nell'identità e nella morfologia delle vertebre sono presenti anche nei serpenti, in cui le vertebre cervicali hanno assunto la facies tipica di vertebre toraciche e come queste portano coste. In concomitanza con questa variazione, l'espressione dei geni Hoxc6 e Hoxc8 ‒ normalmente confinata alla regione toracica dei Tetrapodi ‒ si estende nello sviluppo dei serpenti anche agli abbozzi vertebrali più anteriori (cervicali), che quindi assumono un'identità toracica. Questo fenomeno rappresenta un vero e proprio esperimento di 'guadagno di funzione' dei geni Hox nella zona cervicale, effettuato dalla natura; i risultati di questo 'esperimento' sono del tutto coerenti con le trasformazioni delle identità vertebrali ottenute sperimentalmente nel topo con metodi di transgenesi. In conclusione, si pensa che modificazioni dell'espressione dei geni Hox nello sviluppo abbiano mediato importanti cambiamenti nel corso dell'evoluzione.
Anche altre profonde transizioni evolutive, analizzate in passato e fonte di accese controversie, vengono attualmente riconsiderate alla luce dei dati genetico-molecolari della biologia dello sviluppo: ne è un esempio il problema dell'inversione dell'asse dorso-ventrale tra Artropodi e Cordati. Negli Artropodi il cordone nervoso è ventrale, mentre nei Cordati il sistema nervoso è in posizione dorsale; al contrario, l'aorta è dorsale negli Artropodi e ventrale nei Cordati. Su queste basi, Etienne Geoffroy Saint-Hilaire (1822) ipotizzò che i piani strutturali di questi due phyla fossero gli stessi, benché il loro asse dorso-ventrale fosse stato invertito nel corso dell'evoluzione. In anni recenti, questa idea ha ricevuto conferme molecolari dall'analisi della formazione dell'asse dorso-ventrale in Drosophila e nei Vertebrati. Nei due tipi di organismi geni antagonisti, dorsalizzanti e ventralizzanti, interagiscono a definire la polarità dorso-ventrale (in Drosophila, short gastrulation e decapentaplegic; nei Vertebrati, chordin e BMP-4). Ebbene, tali geni sono omologhi e la loro funzione è conservata, ma viene svolta in posizioni invertite rispetto all'asse dorso-ventrale: i geni dorsali nei Cordati hanno un corrispettivo ventrale negli Artropodi e viceversa, in accordo con l'inversione delle strutture anatomiche.
In conclusione, i meccanismi molecolari sottintesi alla formazione del piano corporeo e all'ontogenesi di molti organi sono ampiamente conservati negli organismi più diversi. Inoltre, i dati raccolti dalla evo-devo rivelano che modificazioni della espressione genica nello spazio e/o nel tempo possono generare variazioni di grande rilievo evolutivo.
Bibliografia
Blitz 2005: Blitz, Ira L. - Andelfinger, Gregor - Horb, Marko E., Germ layers to organs: using Xenopus to study 'later' development, "Seminars in cell and developmental biology", 17, 2005, pp. 133-145.
Carroll 2004: Carroll, Sean B. - Grenier, Jennifer K. - Weatherbee, Scott D., Dal DNA alla diversità, Bologna, Zanichelli, 2004 (ed. orig.: From DNA to diversity, Malden-Oxford, Blackwell Science, 2001).
De Robertis, Kuroda 2004: De Robertis, Edward M. - Kuroda, Hiroki, Dorsal-ventral patterning and neural induction in Xenopus embryos, "Annual review of cell and developmental biology", 20, 2004, pp. 285-308.
Gilbert 1991: A conceptual history of modern embriology, edited by Scott F. Gilbert, New York-London, Plenum, 1991.
Gilbert 2003: Gilbert, Scott F., Developmental biology, 7. ed., Sunderland (Mass.), Sinauer, 2003.
Gould 1977: Gould, Stephen J., Ontogeny and phylogeny, Cambridge (Mass.)-London, Belknap Press of Harvard University Press, 1977.
Tavola I
Embriogenesi: dall’uovo all’organogenesi
Uovo e polarità. L’uovo di Xenopus (fig. 1) è una grande cellula di circa 1 mm di diametro, in cui si distinguono un polo animale pigmentato e un polo vegetativo ricco di materiale nutritizio (deutoplasma o lecite). L’uovo contiene molti altri componenti di derivazione materna – accumulati durante l’ovogenesi –, che l’embrione utilizza per le prime fasi del suo sviluppo. Alcuni componenti hanno una precisa localizzazione, diversa tra i due poli: per esempio, al polo vegetativo sono presenti RNA messaggeri (mRNA) che codificano per proteine segnale della famiglia TGF-b (Transforming growth factors-b) e per il fattore di trascrizione VegT, come anche proteine della via di segnale dei fattori Wnt (fig. 1in basso). La polarità animale-vegetativa dell’uovo corrisponde approssimativamente alla polarità antero-posteriore (A-P) del futuro organismo, mentre la fecondazione innesca un movimento intracellulare (la rotazione corticale) che ne definirà la polarità dorso-ventrale (D-V, fig. 1 in basso). Alla fecondazione, lo strato superficiale del citoplasma ovulare (cortex) ruota di circa 30° rispetto al più denso citoplasma profondo, verso il punto d’ingresso dello spermatozoo. Tale rotazione disloca vescicole contenenti la proteina dishevelled (un componente della via di segnale attivata dalle proteine secrete Wnt) dal polo vegetativo al lato dell’uovo opposto al punto d’ingresso dello spermatozoo. Con la segmentazione, la proteina dishevelled si troverà racchiusa in cellule che daranno origine al dorso del futuro organismo, mentre il ventre si formerà al lato opposto. Nella sua forma attiva infatti dishevelled, con la cooperazione di Wnt11 e di altri componenti materni, innesca nelle cellule che la contengono l’ingresso della b-catenina citoplasmatica nei nuclei e la conseguente espressione di geni che specificano il lato dorsale.
Segmentazione. Lo zigote, embrione a una cellula, inizia una serie di rapidissime divisioni mitotiche sincrone, divenendo in breve tempo multicellulare (fig. 1 in alto). Nella fase iniziale i cicli cellulari mancano delle fasi gap G1 e G2, per cui il volume dell’embrione non aumenta e le sue cellule (blastomeri) divengono progressivamente più piccole. Il genoma embrionale, impegnato in continue fasi S alternate a M, non è disponibile alla trascrizione e l’embrione precoce utilizza materiali e regolatori di derivazione materna. Quando le scorte materne vengono a esaurirsi, l’embrione entra nella fase di ‘transizione di medio-blastula’ (mid-blastula transition), in cui le fasi G sono reintrodotte nel ciclo, le divisioni rallentano e divengono asincrone, i nuclei iniziano a trascrivere e le cellule ad accrescersi. Due caratteristiche
principali determinano la gran varietà dei tipi di segmentazione presenti nei diversi gruppi animali: la quantità e la distribuzione del deutoplasma nel citoplasma dell’uovo, e fattori ereditari, anch’essi citoplasmatici, che influenzano il momento della formazione del fuso mitotico e il suo angolo rispetto all’asse animale-vegetativo. Il processo di segmentazione termina con la formazione della blastula, costituita da migliaia di cellule che racchiudono una cavità chiusa rispetto all’ambiente esterno, il blastocele.
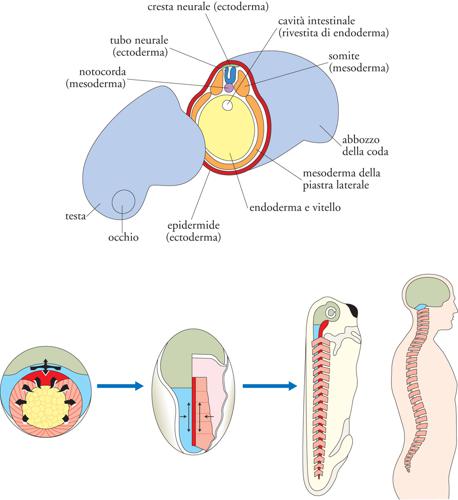
Gastrulazione. Con il diminuire della velocità delle divisioni, inizia una fase di intensi movimenti cellulari che conducono alla riorganizzazione di tutto l’embrione: la gastrulazione, il cui nome indica la prima comparsa di una cavità aperta verso l’ambiente esterno (intestino primitivo o archenteron, fig. 1 in alto). L’apertura dell’archenteron, il blastoporo, darà origine alla bocca nei Protostomi (in cui la bocca si forma per prima), o all’ano nei Deuterostomi (in cui la bocca si forma per seconda). A partire da una blastula poco strutturata, con la gastrulazione si delinea il futuro piano corporeo e, negli animali triblastici, si formano i tre foglietti embrionali – ectoderma, mesoderma ed endoderma – fondamentali per la costruzione del corpo e per il differenziamento dei tessuti. Con i movimenti della gastrulazione le cellule del mesoderma e dell’endoderma migrano all’interno dell’embrione, mentre rimangono a rivestirlo le cellule dell’ectoderma (fig. 2 in alto). Con il proseguimento dello sviluppo l’ectoderma darà origine al rivestimento epiteliale esterno, l’epidermide, ma anche al sistema nervoso; l’endoderma sarà il foglietto più interno, da cui derivano l’apparato digerente (il tubo intestinale con le sue differenziazioni e annessi) e l’apparato respiratorio; il mesoderma produrrà i tessuti muscolare e connettivo, originando così lo scheletro, la parete del corpo, ma anche il cuore, il derma, i reni, la componente somatica delle gonadi, il sangue.
Anche se esiste una gran varietà di modelli di gastrulazione, questi si attuano attraverso pochi tipi di movimenti cellulari;
tra questi il movimento di estensione convergente, evolutivamente molto conservato, è essenziale alla costruzione dell’asse dorsale dei Cordati. L’estensione convergente restringe (convergenza) l’embrione lungo l’asse medio-laterale e lo allunga (estensione) lungo l’asse antero-posteriore, determinando così la sua polarità morfologica e funzionale, con la testa a un estremo e la coda all’altro (fig. 2 in basso). L’estensione convergente interessa tutti e tre i foglietti nella loro componente dorsale: le cellule del mesoderma dorsale presuntivo disegnano la struttura assile dell’embrione, la notocorda (poi sostituita nei Vertebrati dalla colonna vertebrale); le sovrastanti cellule di ectoderma a destino neurale (neuroectoderma) convergono e si estendono a originare l’encefalo posteriore e il midollo spinale presuntivi; il sottostante endoderma dorsale contribuirà al tubo intestinale. Con l’estensione convergente l’embrione perde la forma sferica, acquisisce l’asse anteroposteriore e forma il proprio asse dorsale.
Neurulazione (organogenesi). La neurulazione è il processo attraverso cui nei Cordati la piastra neurale, un foglietto piatto di cellule di ectoderma dorsale (neuroectoderma), forma il tubo neurale, il primordio dell’intero sistema nervoso centrale (figg. 1 in alto e 2 in alto). La neurulazione comprende una serie di movimenti morfogenetici orchestrati con precisione, sia nella stessa piastra neurale sia nell’ectoderma circostante. Inizialmente le cellule del neuroectoderma si allungano in senso apico-basale, a differenza delle circostanti cellule a destino epiteliale; inoltre, grazie all’estensione convergente la piastra neurale posteriore si restringe in senso medio-laterale e si allunga in direzione rostro-caudale (fig. 2 in basso). Lungo i bordi della piastra si sollevano le pliche neurali, che fondendosi lungo la linea dorsale mediana generano il tubo neurale, al di sopra del quale si salda l’ectoderma a destino epidermico (fig. 2 in alto). In questo processo, la piastra neurale si incurva lungo il solco ventrale mediano e lungo due solchi laterali simmetrici, generando prima la doccia neurale e consentendo, quindi, la chiusura dorsale del tubo neurale. Le cellule che fiancheggiano la linea di chiusura – cellule della cresta neurale – migrano in siti diversi a dare origine a una varietà di tessuti.