borani
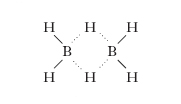
Composti binari di boro e idrogeno aventi formule BnHn+4 (con n = 2,5,6,10) o BnHn+6 (con n = 4,5). In base al numero di atomi di boro presenti nella molecola vengono denominati di-b. o tetra-b. e così via. La struttura dei b., non interpretabile con le comuni regole della valenza, ha fatto sorgere un interessante problema teorico. Nel 1929 W.O. Dilthey propose l’interpretazione attualmente più accreditata, secondo la quale ogni atomo di boro impegna 2 dei suoi 3 elettroni di valenza per formare legami covalenti con l’idrogeno mentre l’elettrone residuo è impegnato in un legame di tipo diverso detto a tre centri. In esso i 2 atomi di boro sono legati tra loro attraverso un atomo di idrogeno mentre i due elettroni di valenza (uno dell’idrogeno e l’altro di uno dei due atomi di boro) sono delocalizzati sui tre atomi. Tale configurazione è resa possibile dal fatto che l’atomo di boro dispone di tre elettroni e di quattro orbitali di valenza, per cui l’orbitale non occupato (del tipo ibrido sp3) può essere utilizzato per la formazione del legame a tre centri; per es., il di-b. ha formula di struttura:
(i legami covalenti sono a linea continua, quelli a tre centri sono tratteggiati). Nelle molecole come il di-b. i due legami a tre centri sono da considerarsi solo formalmente distinti, in quanto, in realtà, i 4 elettroni risultano indifferentemente delocalizzati sui 4 atomi. L’ipotesi di Dilthey è stata successivamente confermata mediante la spettrometria nell’ultravioletto, infrarosso e Raman.
Il di-b. (gassoso) si prepara per azione del fluoruro di boro sull’idruro di litio; i b. superiori (liquidi o solidi) riscaldando sotto pressione o in presenza d’idrogeno i termini inferiori della serie. Sono sostanze di odore sgradevole, decomponibili al calore e per contatto con l’acqua o con l’aria (nel quale ultimo caso possono dar luogo, a eccezione del deca-b., a reazione esplosiva), che hanno assunto notevole importanza per le loro caratteristiche proprietà riducenti e come intermedi in preparazioni organiche in virtù della loro reattività. Interessanti sono anche le possibilità d’impiego che i b. presentano nel campo dei propellenti ad alto potenziale energetico.
I b. sono generalmente assai tossici (il limite di sicurezza è compreso fra 0,005 e 0,1 ppm a seconda del tipo di composto); pertanto la loro manipolazione è rigidamente regolamentata. La loro azione si esplica per inalazione e per via cutanea: nel primo caso può provocare edema polmonare e ipotensione, nel secondo disturbi nervosi. Tali forme di intossicazione sono contrastate da ossigenazione spinta e somministrazione di barbiturici.