citometria
Conteggio al microscopio delle cellule contenute in un liquido organico: si ottiene con apparecchiature elettroniche che registrano le variazioni di conduttività al passaggio di singole cellule in soluzione entro microcapillari.
La c. a flusso è una metodica ampiamente diffusa, in grado di utilizzare proprietà morfologiche di cellule attraverso un flusso opportunamente distribuito in una strumentazione ottica che utilizza un raggio laser. Consente di evidenziare caratteri fisici della cellula (volume, dimensioni, indici di rifrazione), stabilire il livello di viscosità, descrivere alcuni aspetti chimici, quali il contenuto di acidi nucleici nelle varie fasi del ciclo cellulare. È possibile studiare circa 5000 cellule al secondo e le varie generazioni di apparecchi tendono a migliorare le prestazioni aggiungendo opzioni di varia natura.
I dati forniti nel corso di un’indagine citofluorimetrica derivano da segnali luminosi raccolti frontalmente e ortogonalmente rispetto al raggio laser. Un sistema computerizzato permette di distinguere le varie caratteristiche, per ogni cellula indagata. Rappresentando in modo opportuno (per es., un piano cartesiano) i parametri che interessano, risulta possibile ottenere una buona descrizione dei caratteri esplorati. L’applicazione di anticorpi monoclonali fluorescenti ha permesso, nei sistemi di c., di indagare sulle caratteristiche di membrana dei linfociti. Un progresso nello studio delle cellule è stato possibile grazie all’uso di fluorocromi associati ad anticorpi monoclonali con CD (➔) caratterizzanti un certo stadio differenziativo delle cellule.
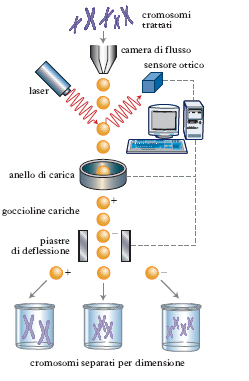
È prassi comune in laboratorio diagnostico utilizzare una c. a doppia o tripla fluorescenza. Nel caso della c. a doppia fluorescenza si possono impiegare due anticorpi monoclonali rivolti verso molecole note presenti sulla membrana di una cellula e ottenere informazioni sulla distribuzione qualitativa e quantitativa delle molecole indagate. Infatti, emettendo la fluorescenza applicata ai CD su lunghezze d’onda diverse, è riconoscibile su un display la distribuzione relativa dei due CD impiegati. Un’ulteriore applicazione della c. è il metodo FACS (➔), che associa la capacità analitica di identificazione cellulare con la possibilità di isolare e raccogliere in modo selettivo le cellule purificate. In tal modo si hanno a disposizione popolazioni cellulari altamente selezionate per il tipo di impiego necessario alla sperimentazione prefissata. Procedimenti di questo tipo hanno anche reso possibile il frazionamento dei singoli cromosomi nelle cellule di mammifero (v. fig.). Questa applicazione della c. a flusso è stata molto utile negli studi effettuati nel corso degli anni 1990 per la definizione delle mappe genetiche nell’uomo. Il fatto di avere a disposizione singoli cromosomi purificati ha infatti consentito la produzione di genoteche specifiche per ogni cromosoma. Il DNA purificato da ogni cromosoma può essere amplificato sia con metodi di clonaggio basati su cellule (➔ genetica), sia con PCR. Sono state particolarmente utili per la determinazione della completa sequenza del genoma umano genoteche cromosoma-specifiche costruite usando come vettori cosmidi o cromosomi artificiali di lievito (YAC). Risulta evidente che, usando queste genoteche, si riduce il numero di cloni da saggiare per identificare un gene di uno specifico cromosoma. Questo è particolarmente vero nel caso in cui il gene interessato sia già stato mappato su un cromosoma mediante altri metodi, quali ibridazione di cellule somatiche o FISH (➔ citogenetica).