pirrolo
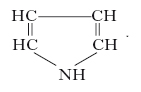
Composto eterociclico, di formula C4H5N, scoperto nel 1834 da F.F. Runge nel catrame di carbon fossile, riscontrato poi nell’olio di Dippel. È un liquido incolore, che imbrunisce all’aria, dall’odore non sgradevole, insolubile in acqua; deve il suo nome alla proprietà che hanno i vapori di colorare in rosso una scheggia di legno di pino inumidita con acido cloridrico. Si prepara per riscaldamento dell’acido glutammico e successive pirolisi dell’acido pirrolidoncarbossilico così ottenuto; si ottiene anche per sintesi di Knorr. Ha carattere aromatico dovuto alla delocalizzazione dei 4 elettroni π dell’anello e alla coppia elettronica non impegnata dell’azoto ed è chimicamente simile al fenolo, però i derivati alchilati hanno deboli proprietà basiche; il p. libero trattato con acido cloridrico polimerizza dando una polvere amorfa rossa (detta rosso di p.). La struttura del p. è rappresentata da un anello pentatomico; la nomenclatura dei numerosi derivati si basa sulla posizione in cui è avvenuta la sostituzione che parte dall’atomo di azoto
Data la reattività del nucleo del p., i suoi composti sono numerosi: fra essi particolarmente importanti sono gli idrossipirroli, che possono contenere ossidrili sostituiti al nucleo o in catene laterali e che hanno interesse per le relazioni coi pigmenti biliari; le aldeidi pirroliche, che rappresentano importanti intermedi nella preparazione, per es., di acido pirrolcarbossilico; i coloranti pirrolici, i pigmenti pirrolici (per es., ftalocianine); le pirrolidine; i pirrolidoni. Il p. è un acido molto debole ma può essere salificato con una base molto forte; si ottengono così sali (detti talvolta pirrolati) in cui l’anione deriva dal p. per scissione eterolitica del legame azoto-idrogeno; questi sali sono utilizzati per ottenere gli N-derivati del pirrolo. Molti derivati, abbondanti in natura, hanno interesse biologico; infatti l’anello pirrolico è presente nelle emoproteine, nella clorofilla, nell’urobilina, nei pigmenti biliari, nelle porfirine, in alcaloidi (nicotina, atropina, cocaina) e amminoacidi (prolina, ossiprolina); derivati del p. hanno interesse per applicazioni mediche.
Pirrolidina Composto chimico di formula C4H9N, tetraidroderivato del pirrolo. Si ottiene industrialmente trattando il furano con ammoniaca a circa 400 °C in presenza di ossido d’alluminio; è un liquido incolore, mobile, dall’odore pronunciato di ammina, miscibile con acqua e con la gran parte dei solventi organici. Il nucleo della pirrolidina è presente in alcuni alcaloidi, perciò detti pirrolidinici. La pirrolidina, abbastanza tossica, infiammabile e irritante della pelle, dà origine a importanti prodotti: per ossidazione energica l’anello si apre con formazione di acido amminobutirrico, mentre per deidrogenazione dà p.; forma prodotti di condensazione con la formaldeide, con i fenoli ecc.; derivati di un certo interesse si ottengono introducendo gruppi sostituenti sull’atomo di azoto. Alcuni di questi derivati trovano impiego come prodotti antiossidanti, come acceleranti della vulcanizzazione, come insetticidi. Pirrolidone Composto eterociclico, chetoderivato della pirrolidina, C4H7NO, di cui sono noti 2 isomeri. L’α-pirrolidone ha particolare importanza pratica perché è la materia prima per la preparazione del polivinilpirrolidone; si può preparare a partire da acetilene e formaldeide.