colesterolo
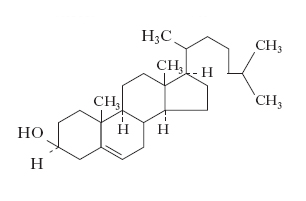
Sterolo presente solo negli organismi eucariotici, in cui si trova allo stato libero o combinato con acidi grassi sotto forma di estere. La sua molecola è costituita da 4 anelli condensati indicati con le lettere A, B, C e D. Agli atomi di carbonio C-10 e C-13 sono attaccati gruppi metilici, mentre al C-17 una catena alifatica. Tra il C-5 e il C-6 è presente un doppio legame e al C-3 è legato un gruppo ossidrilico. Quest’ultimo è l’unico sostituente polare del c., che pertanto risulta essere una molecola estremamente idrofobica:
La colesteroloesterasi è l’enzima presente nel sangue, nel fegato, nella milza, nella bile e nel succo pancreatico, che catalizza la scissione e la formazione degli esteri del c., sostanze facilmente assimilabili che permettono il rapido passaggio del c. dall’intestino alle vie linfatiche e quindi al circolo sanguigno. Il c., per la maggior parte associato a lipoproteine, si trova in tutti i tessuti ed è particolarmente abbondante nel cervello e nelle ghiandole surrenali. In diverse malattie degenerative (per es., l’aterosclerosi) si hanno accumuli di composti colesterolici nei tessuti, spesso accompagnati da ipercolesterolemia.
Dai calcoli biliari, che ne sono ricchissimi, il c. si può facilmente ottenere allo stato puro cristallino. La sequenza delle reazioni di sintesi ha inizio con la condensazione di 3 molecole di acetilcoenzima A per formare 3-idrossi-3-metil-glutaril-CoA; attraverso la sintesi di acido mevalonico si giunge alla formazione di isopentenilpirofosfato e dimetilallilpirofosfato che, per successive condensazioni, sono trasformati in farnesilpirofosfato (un composto a 15 atomi di carbonio). Da due molecole di quest’ultimo è prodotto lo squalene, triterpene a 30 atomi di carbonio. La trasformazione dello squalene in squalene-2,3-ossido e successivamente, per mezzo di una ciclizzazione enzimatica anaerobica, in lanosterolo è necessaria per arrivare al prodotto finale colesterolo.
Il processo di sintesi del c. si svolge particolarmente a livello del fegato, ma è stato anche dimostrato in numerosi altri organi (polmone, surrene, testicolo, ovaio, arterie ecc.). La cessione del c. dal fegato avviene in due direzioni: nel sangue e nella bile. Data la sua scarsa idrosolubilità, il c. deve essere legato in questo caso a un vettore o a un agente solubilizzante, come le apolipoproteine specifiche. Infatti il c. è ceduto al sangue con le VLDL (very low-density lipoprotein) e le HDL (high-density lipoprotein) formate nel fegato; in seguito, le VLDL vengono trasformate nelle LDL (low-density lipoprotein) particolarmente ricche di c., durante la successiva circolazione nella corrente sanguigna. L’eliminazione del c. con la bile avviene in seguito alla sua trasformazione in acidi biliari e successivamente in sali biliari. Il c. viene degradato in acido colico attraverso una sequenza di reazioni di ossidrilazione, ossidazione, oltre che di isomerizzazione e riduzione del doppio legame tra il C-5 e il C-6 del c. Viene così prodotto acido colico che, attraverso una reazione di coniugazione, dà origine ai sali biliari.
Dal c., mediante modificazioni ancora non ben note della catena laterale isottilica e la scissione di questa in corrispondenza dell’atomo di carbonio 20, si forma uno steroide a 21 atomi di carbonio, il pregnenolone, precursore del progesterone, degli ormoni corticosurrenalici, degli androgeni e degli estrogeni. Nella mucosa intestinale, nella cute e in altri tessuti, il c. è deidrogenato a 7-deidrocolesterolo, o provitamina D3.
La concentrazione di c. nel sangue ( colesterolemia) è uno dei principali parametri che deve essere valutato per calcolare il rischio cardiovascolare (probabilità di insorgenza di eventi quali infarto del miocardio, ictus cerebri ecc. ➔ ipercolesterolemia). La classificazione attuale si basa su specifici limiti relativi al c. totale e alle quote che circolano legate a lipoproteine dalla densità variabile (HDL e LDL). Nello specifico, si considerano ‘desiderabili’ valori di c. totale inferiori a 200 mg/dl ed elevati quelli superiori a 240 mg/dl. In relazione al rischio cardiovascolare, particolare attenzione è concentrata sul c. LDL, considerato come il principale responsabile del rischio aterogeno; per tale frazione della colesterolemia i valori ‘ottimali’ sono scesi al di sotto di 100 mg/dl, considerando già ‘moderatamente elevato’ il vecchio limite di 130 mg/dl. Al contrario, i dati epidemiologici indicano che un valore troppo basso (〈40 mg/dl) di colesterolo HDL rappresenta un fattore di rischio cardiovascolare indipendente, per cui sono consigliabili interventi, farmacologici e non.
Una presenza superiore di c. nell’urina ( colesteroluria) si ha in diverse malattie renali e nei casi di ipercolesterolemia.
Una classe di farmaci che agiscono inibendo l’attività dell’enzima 3-idrossi-3-metilglutaril-CoA-reduttasi, che catalizza la prima reazione limitante nella biosintesi del c., sembra particolarmente efficace nella terapia dell’ipercolesterolemia familiare. Infatti, il trattamento con acido mevinolinico, un inibitore competitivo del suddetto enzima, con colestirammina riduce della metà la concentrazione plasmatica del colesterolo.