penicillina
Antibiotico elaborato da Penicillium notatum. La sua scoperta, che segna l’inizio dell’era degli antibiotici, spetta ad A. Fleming, il quale nel 1932 osservò, in piastre di agar seminate con stafilococchi e incidentalmente inquinatesi con Penicillium notatum, la scomparsa di colonie batteriche in vicinanza degli inquinamenti. Fleming diede il nome di p. al principio antibatterico elaborato dal fungo, ma non riuscì a isolarlo, cosa che invece fecero, nel 1940, E.B. Chain e H.W. Florey dell’università di Oxford. Questi ricercatori dimostrarono poi (1941) sperimentalmente che l’azione della p. si esplicava oltre che in vitro anche in vivo.
Azione
Alla p. sono sensibili: a) la grande maggioranza dei germi patogeni gram-positivi: stafilococchi (a eccezione di particolari ceppi), streptococchi piogeni (eccetto alcuni ceppi della varietà viridante), pneumococchi, il bacillo del tetano e altri clostridi, il bacillo difterico, gli actinomiceti, le spirochete; b) alcuni germi patogeni gram-negativi e segnatamente il meningococco e il gonococco. Scarsamente sensibili o addirittura insensibili all’azione della p. sono il bacillo di Koch e gli altri micobatteri, le brucelle, il proteo, il piocianeo, il bacillo di Friedländer, le shigelle, le salmonelle, il colibacillo, l’enterococco, gli emofili, le rickettsie, i virus, i miceti e i protozoi.
La p. ha un’azione prevalentemente battericida, poiché si lega al protoplasma dei batteri che vanno incontro a fenomeni degenerativi e poi alla morte; ma perché questa azione si esplichi è indispensabile che i germi siano in fase proliferativa: la p., infatti, a differenza degli antisettici, è inattiva sui germi in fase di quiescenza.
Altra caratteristica dell’azione della p. è quella di non essere influenzata né dalla concentrazione batterica né dai prodotti di disfacimento dei tessuti; inoltre, dopo che il suo tasso plasmatico è sceso sotto il livello utile, deve trascorrere un certo periodo di tempo prima che i germi riprendano a moltiplicarsi e in questo periodo di tempo essi sono particolarmente soggetti ai normali meccanismi difensivi degli organismi. Gli aumenti sopra il livello utile della concentrazione di p. non sono causa di un aumento del potere battericida, ma esclusivamente di un mantenimento per un periodo più lungo di detto livello. L’attività è esaltata da alcuni ioni (Cd, Co, Mn) e depressa da altri (Cu, Hg, Pb).
La p. viene rapidamente distrutta dalle penicillasi, enzimi (peso molecolare di ca. 50.000) prodotti da batteri penicillino-resistenti (colibacillo, piocianeo, proteo), che idrolizzano la p. a sostanze prive di attività antibiotica. Le penicillasi inattivano la p. rompendo il legame ammidico del suo anello β-lattamico.
Somministrazione
Rispetto agli altri antibiotici, la p. possiede il pregio di unire a una grande attività antibatterica un’ottima solubilità e una tossicità praticamente nulla: l’uomo adulto può sopportare dosi giornaliere superiori a 100 milioni di Unità Internazionali (UI); la dose media terapeutica per l’uomo adulto è di 600.000-2.000.000 di unità per via parenterale. L’UI, o unità Oxford, corrisponde a una quantità pari a 0,6 c del preparato standard internazionale del sale sodico di p. G cristallizzata.
La p., pur non essendo di per sé tossica, tuttavia è dotata di potere antigenico, così che il suo uso può causare reazioni allergiche (dermatiti da contatto, fenomeni urticaroidi, esantemi, febbre) che talvolta hanno carattere di gravità (shock anafilattico).
Il grande inconveniente della p. è di essere eliminata, soprattutto dai tubuli renali, con estrema rapidità. Per ovviare a ciò si è cercato di trovare, in un primo tempo, sostanze (probenecid) in grado di ostacolarne l’eliminazione tubulare e, successivamente, altre che, rendendola meno solubile, ne ritardassero l’assorbimento (procaina, N, N′-dibenziletilendiammina ecc.). I preparati penicillinici che contengono queste ultime sostanze sono detti p.-ritardo. Oltre a p. attive esclusivamente per via parenterale ne sono state preparate altre attive per via orale, perché dotate di stabilità in ambiente acido (e quindi resistenti ai succhi gastrici) e rapidamente assorbibili a livello del duodeno; fenossimetil-p. (o p. V), fenossietil-p. ecc.
P. biosintetiche e semisintetiche
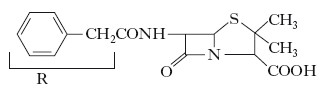
I penicilli non elaborano un’unica p., ma diverse, che differiscono tra loro solo per la catena laterale. Il nucleo fondamentale, che è uguale per tutte le p., è costituito dall’anello tiazolidin-β-lattamico risultante dalla condensazione della β-tiovalina e della glicina acilata, quindi è un dipeptide che, presentando un carbossile libero, ha funzione acida e di conseguenza è in grado di formare sali; quelli di calcio, sodio e potassio, essendo più solubili, sono normalmente utilizzati in terapia. Tra le p., la più usata è la benzilpenicillina (o p. G), che di tutte si è dimostrata la più stabile e la cui formula di struttura è:
Le altre p. differiscono dalla benzilpenicillina per la diversa natura del gruppo indicato nella formula precedente con R. L’osservazione che l’attività delle penicillasi batteriche dipende dalla natura del gruppo laterale R ha permesso la sintesi di p. clinicamente efficaci contro ceppi batterici penicillino-resistenti.
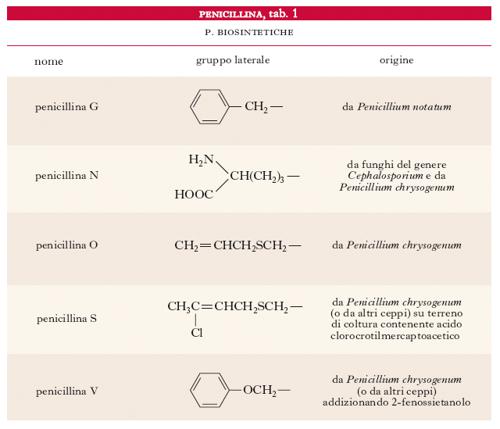
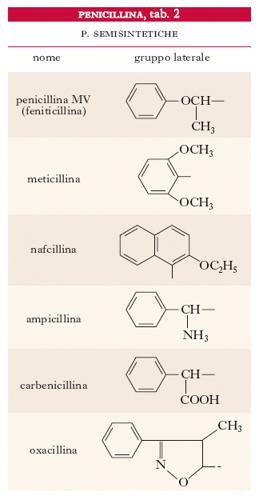
Le p. possono essere biosintetiche (tab. 1), cioè prodotte da particolari ceppi di Penicillium posti in crescita su opportuni terreni, oppure semisintetiche (tab. 2); in tal caso le p. vengono generalmente preparate a partire dall’acido amminopenicillanico tramite introduzione, per via chimica, dei gruppi laterali caratteristici. Le varie p. differiscono, oltre che per la resistenza alla penicillasi, anche per la solubilità e la stabilità in ambiente basico o acido: per es., la p. V è più stabile della p. G in ambiente acido. Si possono inoltre ottenere prodotti aventi attività antibiotica e proprietà chimiche diverse salificando la p. G con basi organiche (N-benzilfenilammina, N, N-dibenziletilendiammina, benzidrilammina, procaina ecc.). Le p. sono acidi monobasici di media forza (formano sali metallici); sono abbastanza stabili nell’intervallo di pH 5-7, ma vengono idrolizzate in ambiente basico o fortemente acido.
Tra i prodotti di degradazione sono da ricordare gli acidi penillico, penicilloico, penaldico e la penicillammina; gli ultimi due prodotti si ottengono dall’idrolisi acida della p. G. La penicillammina si presenta sotto due forme: una destrogira, tossica, antagonista della piridossina; una levogira, ben tollerata, utilizzata nel saturnismo, nel trattamento dell’artrite reumatoide e in corso di malattia di Wilson.
Un metodo molto accurato di determinazione analitica della p. si basa sull’uso di transistori a effetto di campo: lo strato di nitruro di silicio del transistore viene ricoperto con un gel contenente penicillasi, enzima che idrolizza la p. modificandone le proprietà acido-base. Tale modificazione comporta una variazione del pH all’interno del gel e il segnale ricevuto dal sensore può essere correlato alla concentrazione di p. in una soluzione.
Produzione
La produzione delle p. semisintetiche è sempre più affidata a processi biocatalitici, basati sull’impiego di enzimi immobilizzati. La maggior parte della produzione mondiale di acido 6-amminopenicillanico, intermedio chiave nella sintesi delle p. semisintetiche, proviene dall’idrolisi della p. G o della p. V, catalizzata da enzimi penicillasi. Questo metodo consente di ridurre di circa 5 volte i volumi di prodotti di scarto rispetto ai processi chimici tradizionali ed è caratterizzato da minore consumo energetico. Un’ulteriore innovazione riguarda la produzione stessa delle p. a partire dall’acido 6-amminopenicillanico e da un opportuno reagente capace di fornire la catena laterale caratteristica di ciascun antibiotico della famiglia. Mentre tale processo viene tradizionalmente realizzato per via chimica, hanno iniziato a diffondersi processi biocatalitici alternativi (sempre basati su enzimi penicillasi) anche per questo tipo di sintesi. Essi presentano importanti vantaggi di tipo economico e ambientale, perché vengono realizzati in ambiente acquoso anziché in solventi organici, a temperatura ambiente e facendo uso di reagenti facilmente disponibili e meno reattivi rispetto a quelli impiegati nei processi chimici (ammidi o esteri piuttosto che cloruri acidi). Alcune tra le principali p. semisintetiche (amossicillina, ampicillina) sono state già prodotte con queste metodiche.