peptide
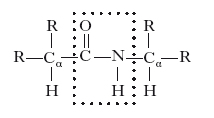
Composto organico risultante dall’unione di due o più molecole di amminoacidi, legati fra loro da legami peptidici: un legame chimico di tipo ammidico che si forma tra il gruppo α-carbossilico di un amminoacido e il gruppo α-amminico di un altro amminoacido con la perdita di una molecola di acqua. Il legame peptidico, o unità peptidica, è costituito dal raggruppamento racchiuso nel riquadro tratteggiato:
dove con R sono indicate le catene laterali degli amminoacidi coinvolti. Il legame tra il carbonio e l’azoto dell’unità peptidica è rigido perché possiede in parte le caratteristiche di un doppio legame; infatti, la sua lunghezza è di 1,32 Å, valore intermedio fra quello di un doppio legame (1,27 Å) e quello di un legame singolo (1,49 Å). Ciò è dovuto alla delocalizzazione degli elettroni del doppio legame dell’ossigeno dell’unità peptidica che, per il fenomeno della risonanza, si spostano sul legame peptidico tra il carbonio e l’azoto, formando un ibrido di risonanza. L’idrogeno del gruppo amminico sostituito è quasi sempre in posizione trans rispetto all’ossigeno del gruppo carbossilico. Gli atomi di carbonio α sono legati all’unità peptidica da legami singoli, quindi hanno libertà di rotazione intorno a questi legami. Queste rotazioni sono determinate dagli angoli ψ(Cα−C) e ϕ(N−Cα) e sono funzione degli ingombri sterici costituiti dalle catene laterali R. A seconda del numero di amminoacidi presenti, i p. si distinguono in oligopeptidi, fino a 20 amminoacidi, e polipeptidi, strutture costituite da un elevato numero (superiore a 20) di amminoacidi uniti fra loro. Le unità amminoacidiche di un p. sono definite, come per le proteine, residui; il residuo amminoacidico che ha il gruppo amminico libero si chiama residuo ammino-terminale (o residuo N-terminale), quello dalla parte opposta del p., con il gruppo carbossilico libero, è il residuo carbossi-terminale (o residuo C-terminale).
La nomenclatura dei p. si effettua elencando i residui in sequenza a partire dal residuo N-terminale e al nome di ogni residuo, tranne l’ultimo, si appone la desinenza -il. Per es., il tripeptide glutatione è la γ-glutammil-cisteinil-glicina.
I p. si ottengono non soltanto per mezzo di processi di sintesi, ma anche per idrolisi parziale, chimica o enzimatica, delle proteine. Molti p. hanno una notevole attività biologica, svolgendo le funzioni di ormoni, antibiotici, neurotrasmettitori ecc. Tra i p. con attività ormonale i più noti sono l’insulina, il glucagone e l’ACTH, o corticotropina (➔ polipeptide). Alcuni ormoni sono costituiti da un esiguo numero di residui, come l’ossitocina, la bradichinina (ambedue di 9 residui) e il fattore di rilascio della tireotropina (3 residui). Tra i p. brevi sono da ricordare le encefaline e le endorfine, p. cerebrali con attività oppiacea, presenti nella struttura primaria della β-lipotropina. Anche alcuni veleni molto tossici sono dei p., come l’amantina. Infine, un esempio di p. ad azione antibiotica è la gramicidina S.
Il peptidoglicano è una molecola che forma la parete cellulare batterica, composta da molecole peptidiche e da carboidrati. È costituito da tre unità ripetute: un disaccaride formato da NAG (N-acetilglucosammina) e NAM (acido N-acetilmuramico) uniti da un legame β-1,4-glicosidico; un tetrapeptide di sequenza L-ala-D-glu-L-lis-D-ala; un pentapeptide con funzione di ponte formato da cinque unità di glicina. Il tetrapeptide si distingue sia per contenere D-amminoacidi, che non si trovano mai nelle proteine, sia perché il residuo di D-glutammina forma un legame peptidico per mezzo del suo gruppo γ-carbossilico. Le molecole di NAM e NAG si alternano in sequenza, dando luogo a una catena polisaccaridica lineare. La terza unità, il pentapeptide poliglicina, lega trasversalmente i residui di NAM di diverse catene polisaccaridiche, costituendo una struttura reticolare. La sintesi del peptidoglicano avviene nel citoplasma.