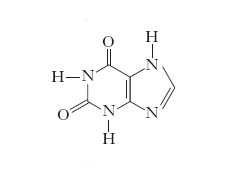
xantina
xantina Composto chimico (2,6-diossipurina)
appartenente al gruppo delle basi puriniche; si trova nel sedimento urinario in forma di sostanza cristallina gialla. Si presenta sotto forma di cristalli incolori, quasi insolubili in acqua fredda; per riscaldamento si decompone sviluppando anidride carbonica, ammoniaca, acido cianidrico; con acido nitrico dà colorazione gialla. È diffusa nel regno animale e in quello vegetale, nel quale sono particolarmente abbondanti i suoi derivati metilati, come le dimetilxantine (teobromina e teofillina) e la trimetilxantina (caffeina).
Negli animali superiori, la x. si forma sia nel metabolismo purinico sia come prodotto del catabolismo dell’ATP, derivando dall’ipoxantina mediante una reazione di ossidazione catalizzata dagli enzimi xantinadeidrogenasi e xantinaossidasi; per opera degli stessi enzimi, la x. è poi trasformata in acido urico, prodotto finale della degradazione delle purine.
L’enzima xantinadeidrogenasi appartiene alla classe delle ossidoreduttasi. Nei Mammiferi, la sua attività è legata al catabolismo delle purine e quindi, indirettamente, allo stato energetico cellulare. Nei Rettili e nei pesci, è particolarmente abbondante nel fegato e nel rene, dove svolge il ruolo fondamentale di eliminazione dell’azoto attraverso la formazione di acido urico. Riguardo alla struttura è una proteina dimerica di due subunità identiche (ognuna di peso molecolare 150.000), ciascuna delle quali contiene un sistema di trasporto di elettroni costituito da una molecola di FAD, un atomo di molibdeno (IV o VI) e due diversi centri Fe−S. La xantinadeidrogenasi idrossila l’ipoxantina in corrispondenza della sua posizione C(2) e la x. di quella C(8), generando, infine, acido urico che tautomerizza nella forma chetonica più stabile. Il meccanismo d’azione avviene in due tappe: nella prima, si ha l’attacco di un gruppo nucleofilico dell’enzima sull’atomo da idrossilare del substrato; nella seconda tappa, l’atomo di idrogeno del substrato viene eliminato come ione idruro che si combina con l’atomo di Mo(VI), riducendolo a Mo(IV). Infine, una molecola d’acqua stacca il substrato modificato dal gruppo nucleofilico dell’enzima, producendo acido urico. L’atomo di Mo(IV) viene riossidato a Mo(VI) a spese di una molecola di NAD che è ridotta a NADH. L’ossidazione di ponti disolfuro (−S−S−) fra specifici residui di cisteina, o la parziale proteolisi con perdita di un frammento di 20.000 di peso molecolare per ciascuna subunità, modificano il meccanismo di reazione della xantinadeidrogenasi, inducendola a utilizzare non più il NAD, ma l’ossigeno molecolare come accettore di elettroni nella riossidazione del Mo(IV). Così la xantinadeidrogenasi si trasforma di fatto nella xantinaossidasi, che viene successivamente riossidata al suo stato di ossidazione originario per reazione con l’O2. Grazie ad analisi spettrografiche è stato dimostrato che gli elettroni vengono incanalati dal molibdeno verso gli altri centri di ossidoriduzione dell’enzima, per essere poi passati dal FAD all’ossigeno molecolare, a sua volta trasformato in H2O2, agente ossidante potenzialmente pericoloso, poi dismutato in acqua e O2 dall’enzima catalasi. Se la reazione di riduzione dell’O2 si verifica in due tappe distinte, con due diverse molecole di O2, si provoca la formazione di due molecole di superossido (➔), da cui si possono originare altre specie radicaliche dell’ossigeno dannose per gli organismi. A tale proposito, è stato osservato negli animali da esperimento che, a seguito di fenomeni di ischemia, si determina un aumento del calcio libero citoplasmatico che provoca l’attivazione di proteasi Ca2+-dipendenti, le quali trasformano la xantinadeidrogenasi in xantinaossidasi. Contemporaneamente, con l’arresto dei processi ossidativi mitocondriali si va incontro agli eventi biochimici caratteristici del fenomeno ischemico, che culminano, nella fase di riperfusione, nella generazione di radicali liberi dell’ossigeno. La possibilità che la xantinaossidasi sia una delle principali fonti di tali radicali nei tessuti ischemici e post-ischemici è stata confermata, in alcuni casi, dall’osservazione sperimentale che l’allopurinolo, un inibitore competitivo della xantinaossidasi e della xantinadeidrogenasi, è in grado di ridurre il danno perossidativo di membrana osservabile dopo ischemia e riperfusione.
Il deficit di xantinaossidasi causa la xantinuria, rara anomalia congenita del metabolismo purinico, con conseguente accumulo tessutale di x. (che è abbondantemente eliminata con le urine e può formare calcoli delle vie urinarie) e scarsissima o assente formazione di acido urico. Xantosina Ribonucleoside della x., di formula C10H12N4O6, prodotto per deamminazione della guanosina; per idrolisi dà x. e ribosio. Xantosinmonofosfato Ribonucleoside monofosfato della x., di formula C10H11N4O9. Indicato dalla sigla XMP, è un intermedio nella via di conversione dell’inosinmonofosfato (IMP) in guanosinmonofosfato (GMP). La sua via di degradazione è comune a quella del GMP e dell’adenosinmonofosfato (AMP), tutte convergenti nella formazione di x. e nella sua ossidazione ad acido urico. Lo XMP viene idrolizzato, per opera della 5′-nucleotidasi, a xantosina successivamente convertita in xantina.