miosina
Proteina enzimatica, presente nelle cellule eucariotiche, che, in associazione con l’actina, è coinvolta in quasi tutti i fenomeni di contrattilità cellulare (contrazione muscolare, movimento ameboide, fagocitosi, flusso citoplasmatico, endocitosi, esocitosi ecc.), durante i quali è in grado di idrolizzare molecole di ATP. Presenta differenze strutturali nelle diverse specie e, all’interno dello stesso organismo, ha differenti isoforme.
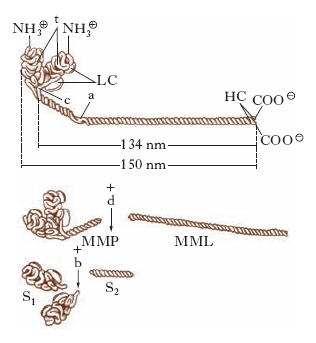
È una proteina esamerica di forma bastoncellare (lunga circa 150 nm) costituita da 6 catene polipeptidiche, 2 catene pesanti, e 4 catene leggere. Le 2 catene pesanti, identiche fra loro e con peso molecolare di 200.000, sono costituite da 1800 amminoacidi ciascuna. Per gran parte della m., ogni catena pesante ha una conformazione ad α-elica e le 2 catene sono avvolte a spirale una sull’altra. A un’estremità della molecola le 2 catene pesanti si separano ripiegandosi in 2 strutture globulari che formano le cosiddette teste (S1 in fig. 1). Le regioni flessibili sono 2: lo snodo (c), punto di congiunzione tra le teste e la porzione filamentosa, e la cerniera, localizzata sulla porzione filamentosa vicino allo snodo. Alle 2 teste globulari sono associate 4 catene leggere, uguali a due a due, che possono essere di 3 tipi differenti. Una coppia è costituita da un polipeptide di peso molecolare 18.000, che è sempre presente su ciascuna testa della miosina. L’altra coppia di catene leggere può essere del tipo LC1 (peso molecolare 25.000) o LC2 (peso molecolare 16.000). La presenza delle catene leggere è fondamentale sia per l’attività adenosintrifosfatasica della m. che per il meccanismo della formazione del complesso actina-miosina. Studi sulla struttura della miosina hanno dimostrato che, per azione della proteasi tripsina, si scinde la molecola di m. nel punto della cerniera, ottenendo i frammenti meromiosina leggera (MML, o LMM) e meromiosina pesante (MMP, o HMM), di cui solo il secondo presenta attività enzimatica e si combina con l’actina.
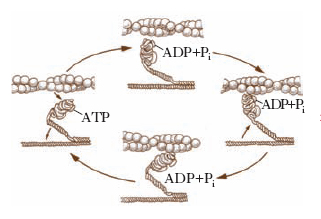
L’attività enzimatica adenosintrifosfatasica intrinseca della m. risiede nelle sue teste ed è stimolata da alcuni ioni (K+, Mg2+, Ca2+); la cinetica d’idrolisi dell’ATP comporta la formazione di almeno sette composti intermedi o condizioni attivate. La m. si trova come complesso M-ADP-Pi quando non è impegnata in attività contrattili. Nel momento in cui vi è la necessità di iniziare un processo contrattile, il complesso M-ADP-Pi si lega con l’actina formando il cosiddetto complesso actina-m., la cui velocità nell’idrolizzare l’ATP è oltre 200 volte superiore a quella della m. da sola. Il legame fra la m. e l’actina, che si verifica sulle teste globulari della m., provoca il rapido distacco di ADP e Pi dal sito attivo della m., che è la causa dell’aumento della velocità di idrolisi dell’ATP. Si suppone che l’energia libera resasi così disponibile induca un cambiamento conformazionale della testa della m., tale che la sua inclinazione rispetto all’actina passi da 90° a 45°. Questa flessione provocherebbe il trascinamento del filamento di actina di 4 o 5 nm lungo la molecola di m. e quindi costituirebbe il cosiddetto colpo di forza nel quale è racchiusa l’energia meccanica indispensabile per ciascun evento contrattile. Poiché nel frattempo il sito catalitico della m. è nuovamente disponibile, una nuova molecola di ATP si lega alla testa della m. in posizione flessa, inducendo una drastica diminuzione di affinità della m. per l’actina e quindi la dissociazione del complesso actina-miosina. Il ritorno della m. alla sua conformazione originale è possibile grazie all’energia libera sviluppata dall’idrolisi rapida dell’ATP. Completata questa reazione, la m. è pronta per iniziare un nuovo ciclo contrattile (fig. 2). Il tempo totale per completare l’intero ciclo descritto non supera 1 millisecondo.
L’esempio più importante di associazione della m. con i filamenti di actina è quello costituito dall’interazione dei filamenti spessi di m. con i filamenti sottili di actina, fenomeno che si traduce nel meccanismo della contrazione muscolare (➔ muscolare, tessuto). Le diverse forme di m. conosciute, anche se di struttura molto simile, presentano una diversa velocità della reazione di idrolisi dell’ATP, direttamente dipendente sia dal tipo di cellula in cui è presente la m. sia dalla sua localizzazione intracellulare, e quindi dai processi di motilità nei quali è coinvolta.