alcheni
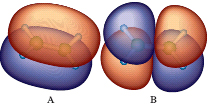
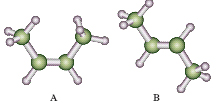
Idrocarburi alifatici, detti anche olefine, aventi formula generale C2H2n. Ciascuno di essi prende il nome del corrispondente alcano cambiando la desinenza -ano in -ene. Come negli alcani, gli atomi di carbonio sono legati in catena, lineare o ramificata, ma due di loro, uno di tipo σ, l’altro di tipo π, adiacenti e ibridizzati sp2, sono uniti da un doppio legame la cui lunghezza è pari a 0,134 nanometri. Gli elettroni del legame σ occupano la regione interposta tra i nuclei, mentre gli elettroni del legame π si trovano nelle due regioni sopra e sotto la linea che congiunge i nuclei; ciò conferisce al doppio legame una geometria planare (fig. 1). L’energia richiesta per rompere un legame π è elevata e di conseguenza la rotazione attorno al doppio legame è impedita. Per questo motivo gli a. possono presentarsi sotto forma di isomeri geometrici, o stereoisomeri, cis e trans. Per es., nel cis-2-butilene i due gruppi metilici si trovano dalla stessa parte del doppio legame, mentre nel trans-2-butilene, si trovano da parti opposte (fig. 2). Gli a. contenenti più doppi legami sono detti polieni.
Gli a. sono sostanze poco polari, insolubili in acqua e solubili in solventi apolari. I loro punti di fusione ed ebollizione sono molto simili a quelli degli alcani. Gli a. che contengono fino a 4 atomi di carbonio sono gassosi, quelli che hanno atomi di carbonio compresi da 5 a 16 sono liquidi, gli a. superiori sono solidi cerosi.
Gli a. sono contenuti in piccola quantità nel petrolio. Il processo più comune per produrli è il cracking termico del petrolio, mediante il quale si ottengono però solo gli a. di più basso peso molecolare, in particolare l’etilene e il propilene. Si possono sintetizzare anche mediante disidratazione catalitica degli alcoli, condotta in ambiente acido:
CH3CH2OH → CH2=CH2 + H2O
o tramite la deidrogenazione catalitica degli alcani:
CH3-CH2-CH3 → CH2=CH-CH3 + H2.
Gli a. sono composti relativamente stabili, ma la presenza del doppio legame fra due atomi di carbonio conferisce loro una reattività molto più elevata di quella dei corrispondenti alcani, per cui partecipano a una grande varietà di reazioni chimiche, il che li rende una delle materie prime più importanti della petrolchimica. La reattività si esprime soprattutto in reazioni di addizione, che solitamente coinvolgono la rottura del legame π per formare nuovi legami semplici. L’idrogenazione, che porta alla formazione del corrispettivo alcano, avviene a temperature e pressioni non elevate in presenza di catalizzatori metallici. L’idratazione, utilizzata per produrre etanolo da etilene, avviene a temperature intorno a 250 °C in presenza di un catalizzatore acido. L’alogenazione è invece una reazione spontanea che si completa a temperatura ambiente. Viene largamente sfruttata per produrre dicloro etano a partire da etilene:
CH2=CH2 + Cl2 → CH2Cl-CH2Cl.
Analogamente l’addizione degli acidi alogenidri porta all’ottenimento dei corrispondenti alogenuri alchilici. Un tipo di addizione molto importante dal punto di vista industriale è la polimerizzazione, che consiste nell’addizione di una molecola di a. a un’altra identica, ripetuta virtualmente all’infinito, e che può avvenire per via ionica o radicalica. I polialcheni tecnologicamente più importanti sono il polietilene, il polipropilene e il polibutadiene. Molto importanti sono anche le ossidazioni, che possono avvenire in forma completa, a dare anidride carbonica e acqua, o controllata, in presenza di un catalizzatore. Un esempio tipico e industrialmente importante è quella dell’etilene in presenza di un catalizzatore di argento che produce ossido di etilene (➔) con selettività particolarmente elevate. È curioso osservare che la stessa reazione condotta sul propilene si realizza con selettività verso il corrispondente ossido molto basse, tanto da renderla priva di interesse applicativo. Per azione dell’ozono ha luogo la rottura del doppio legame, per dare chetoni e anidride carbonica. La reazione è detta anche demolizione ossidativa, o ozonolisi.
L’uso industriale degli a. è favorito dal fatto che sono prodotti poco tossici, per i quali non è neppure fissato un valore limite di concentrazione negli ambienti di lavoro. Tuttavia il loro uso industriale è pericoloso a causa dell’elevata infiammabilità ed esplosività.