alcani
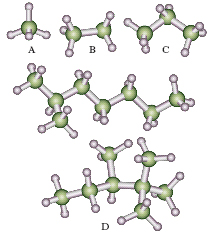
alcani Idrocarburi alifatici (detti anche paraffine), aventi formula generale CnH2n+2. Sono costituiti da una catena aperta di atomi di carbonio ibridizzati sp3 e legati tra loro da legami covalenti semplici di tipo σ, di lunghezza pari 0,153 nanometri. Privi dei legami doppi e tripli che caratterizzano alcheni e alchini, contengono il numero massimo di atomi di idrogeno possibili, e perciò vengono detti saturi. Ogni atomo di carbonio di un a. si trova al centro di un tetraedro, i cui vertici sono occupati dagli atomi a cui esso è legato. I legami formano angoli di 109,45°. I membri più semplici della serie degli a. sono (fig. A-C): il metano, di formula CH4, l’etano (C2H6), il propano (C3H8); tutti gassosi a temperatura ambiente. I termini successivi (fig. D), fino all’esadecano (16 atomi di carbonio), sono liquidi, mentre quelli superiori sono solidi cerosi. Dal butano in poi gli a. possono presentarsi in varie forme isomere; per una data formula bruta gli atomi di carbonio si possono riarrangiare in molti modi diversi con la formazione di catene ramificate. Al crescere del numero di atomi di carbonio nella catena, cresce il numero di isomeri possibili: 2 per il butano, 75 per il decano, 4,11∙109 per il tricontano (a. con 30 atomi di carbonio). Gli a. a catena normale solitamente vengono identificati dal prefisso n-, che sta per normale, mentre quelli ramificati si indicano con il prefisso iso-.
Le molecole di tutti gli a. non sono polari e questa proprietà influenza le loro proprietà fisiche. I loro punti di ebollizione sono più bassi se confrontati con quelli di altre molecole organiche di dimensioni simili. Ciò è dovuto al fatto che le molecole degli a. interagiscono soltanto mediante le relativamente deboli forze di dispersione di London. Poiché esse crescono al crescere dell’area superficiale delle molecole, ne consegue che le temperature di ebollizione e fusione degli a. crescono al crescere del numero di atomi di carbonio contenuti nella molecola. La temperatura di ebollizione per il metano è −162 °C, per l’etano −89 °C, per il butano −0,5 °C. Successivamente i valori crescono di circa 20-30 °C per ogni atomo di carbonio aggiunto in catena. Le temperature di fusione crescono più lentamente di quelle di ebollizione. Gli a. a catena ramificata hanno temperature di fusione ed ebollizione più basse di quelle dei loro isomeri lineari per il fatto che hanno configurazioni più raccolte, la cui area superficiale è minore. Gli a., sempre a causa della non-polarità delle loro molecole, non sono in grado di formare legami idrogeno, per cui risultano insolubili in tutti i solventi polari, tra cui l’acqua. Sono viceversa solubili nei comuni solventi apolari e sono essi stessi utilizzati come solventi. La densità degli a. cresce generalmente al crescere del numero di atomi di carbonio, ma è sempre minore di quella dell’acqua. Gli a. gassosi sono inodori, quelli liquidi hanno l’odore caratteristico della benzina e gli a. superiori solidi sono pressoché inodori.
Le più importanti fonti naturali di a. sono il gas naturale e il petrolio. Il gas naturale contiene soprattutto metano, e altri idrocarburi gassosi più pesanti. Il petrolio è una miscela che contiene per la maggior parte idrocarburi alifatici, sia lineari sia ramificati, oltre a idrocarburi aromatici. I componenti del petrolio vengono separati per distillazione (➔) frazionata. Esistono inoltre svariati metodi per la preparazione degli a., per riduzione di aldeidi e chetoni e idrogenazione degli alcheni, ma anche attraverso sintesi in cui formano nuovi legami carbonio-carbonio, come avviene nell’accoppiamento di alogenuri alchilici, oppure anche mediante reazioni di demolizione di molecole più complesse, come la decarbossilazione dei sali degli acidi carbossilici. Nel cracking, o pirolisi, un a. scaldato ad alte temperature, ed eventualmente in presenza di un catalizzatore, si decompone in carbonio, idrogeno e idrocarburi più leggeri, in quantità che dipendono dalle condizioni di esercizio.
A temperatura ambiente gli a. sono poco reattivi (donde il nome paraffine, dal latino parum affinis). I legami C−C e C−H sono infatti molto stabili. Tuttavia possono partecipare a reazioni di ossidoriduzione, in particolare con l’ossigeno e formano composti con gli alogeni poiché i loro atomi di carbonio si trovano in uno stato fortemente ridotto. L’ossidazione degli a. è una reazione fortemente esotermica, che viene ampliamente utilizzata per produrre energia. Molti a., liquidi e gassosi, sono infatti utilizzati come combustibili, anche per i motori a combustione interna. Nell’alogenazione gli atomi di carbonio vengono progressivamente sostituiti da atomi di alogeni con una reazione molto esotermica, che avviene per via radicalica e che produce una miscela di isomeri in quantità proporzionali alle stabilità dei relativi radicali. I cloroderivati degli a. costituiscono i prodotti di partenza di molte sintesi organiche.