bioinorgànica, chìmica
bioinorgànica, chìmica Branca della chimica che studia la funzione esercitata dagli elementi inorganici classici nella chimica degli esseri viventi, o biochimica. Strutture quali, per es., l’esoscheletro di un mollusco o i denti e l’endoscheletro di un mammifero sono realizzate in natura con i cosiddetti biominerali, cioè sostanze inorganiche come carbonato di calcio, silice ecc., che si sviluppano in aggregati cristallini analoghi a quelli dei minerali sulla crosta terrestre, ma il cui accrescimento è regolato dal metabolismo dell’essere vivente. Rimane ancora molto da capire sui meccanismi attraverso i quali l’organismo guida e controlla l’accrescimento dei biominerali.
La chimica degli elementi metallici negli esseri viventi è essenzialmente la chimica delle loro soluzioni acquose, perché l’acqua è la sostanza (inorganica) più abbondante negli esseri viventi. Gli elementi metallici si trovano sempre sotto forma di cationi coordinati da altri atomi che formano con essi legami covalenti più o meno polari. In particolare le proteine contengono gruppi di atomi particolarmente adatti a funzionare come ligandi di ioni metallici. Le tre funzioni principali degli ioni metallici nelle metalloproteine sono quelle di mantenere la struttura di queste ultime (ruolo strutturale), di legare l’ossigeno per la funzione respiratoria (ruolo di trasporto di ossigeno) e di cambiare numero di ossidazione accettando e cedendo elettroni. I metalli con ruolo strutturale sono il magnesio, il calcio, lo zinco. Gli altri due ruoli sono ricoperti quasi esclusivamente da metalli di transizione. I composti di coordinazione relativi hanno spesso la proprietà di poter variare facilmente il numero di coordinazione, vale a dire di poter legare temporaneamente un ulteriore ligando oltre a quelli forniti dalla proteina, e inoltre di poter cambiare il numero di ossidazione.
Alcuni tra i principali gruppi metallo-leganti, responsabili per es. del trasporto di ossigeno, si trovano rispettivamente nell’emoglobina e nella mioglobina che usano il gruppo prostetico eme, che a sua volta lega uno ione Fe2+ coordinato da catene laterali imidazoliche dell’amminoacido istidina. Molte metalloproteine di trasporto elettronico sfruttano la stessa struttura ferro-eme con la differenza che le due posizioni di coordinazione assiale sono entrambe occupate da ligandi della proteina stessa, e quindi il ferro non può interagire con ligandi esterni come l’ossigeno.
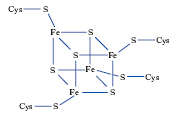
Oltre alle emoproteine, altre tipiche metalloproteine di trasporto elettronico sono le cosiddette proteine a ferro-zolfo. La proteina lega atomi di ferro tramite i gruppi tiolati delle catene laterali dell’amminoacido cisteina; gli atomi di ferro sono ulteriormente legati da ioni solfuro per formare un aggregato, o cluster rappresentato in fig. 1. Il numero di ossidazione di tutto il cluster Fe4S4 può variare di una unità, permettendo alla proteina di esercitare la sua funzione di trasporto elettronico. Le proteine a ferro-zolfo si trovano in un gran numero di organismi, dalle forme di vita primordiali precedenti i Batteri (Archaea) all’uomo. Alcune recenti teorie sull’evoluzione della vita sulla Terra ipotizzano addirittura che i primi sistemi chimici dotati della capacità di autoriprodursi siano originati dall’interazione di alcune semplici sostanze organiche con la pirite (FeS2) per formare clusters ferro-zolfo.
L’importanza degli elementi metallici nei sistemi biologici è esemplificata ancora meglio dai metalloenzimi. Un importantissimo metalloenzima della classe delle ossidoreduttasi è la citocromo-c-ossidasi, che è coinvolta nel passaggio chiave per l’utilizzazione della capacità ossidante dell’ossigeno nel metabolismo degli organismi aerobi. Un’altra classe in cui i metalloenzimi sono particolarmente numerosi è quella delle idrolasi. Spesso le idrolasi contengono zinco, un metallo che non può svolgere funzioni di ossidoriduzione perché ha gli orbitali d completamente riempiti e un solo numero di ossidazione accessibile: +2, lo zinco è quindi molto adatto a legare transitoriamente il substrato che deve subire la reazione e, nel caso delle idrolasi, ad attivare per coordinazione la molecola d’acqua che deve attaccare il substrato stesso. Metalloenzimi fra i più interessanti e importanti per la loro funzione sono l’enzima nitrogenasi e gli enzimi coinvolti nel ‘fotosistema II’ (fig. 2). La nitrogenasi catalizza la reazione di fissazione dell’azoto atmosferico, molecola particolarmente inerte, in alcuni batteri (detti appunto azoto-fissatori), mentre l’altro sistema fotosintetico è responsabile della produzione di ossigeno da parte delle piante e di alcuni batteri.