infarto
Lesione anatomica dovuta alla cessata o marcatamente ridotta irrorazione sanguigna di un tessuto che, pertanto, risulta privato di ossigeno e di fattori nutrizionali (➔ anche ischemia).
L’i. si verifica per lo più in seguito a coagulazione del sangue nell’interno di un’arteria (trombosi), alla presenza di un embolo che determini l’ostruzione del vaso (embolia), o a prolungata costrizione di un vaso arterioso terminale (vasospasmo). Conseguenza inevitabile è in ogni caso la necrosi dei tessuti, privati della irrorazione sanguigna, a causa dell’arresto dei cicli ossidativi cellulari responsabili della produzione di energia (ATP). Nella sede dell’i. i processi riparativi tendono a sostituire i tessuti caduti in necrosi con tessuto connettivo cicatriziale. Se l’i. è stato provocato da un embolo infetto, o se è divenuto sede di arrivo o di sviluppo di germi patogeni si può avere la suppurazione e il quadro clinico della setticopioemia. La sintomatologia dell’i. varia a seconda dell’organo interessato, dell’estensione e della conseguente insufficienza d’organo. La cura può essere medica oppure chirurgica (come nell’i. dell’intestino e in quello dell’utero).
I. del miocardio
L’i. del miocardio (o i. cardiaco o, nel linguaggio comune, semplicemente i.) è dovuto a una trombosi di un’arteria coronarica del cuore o comunque a una sua occlusione. Le occlusioni trombotiche hanno origine per lo più dalla improvvisa fissurazione o rottura di una preesistente placca aterosclerotica
(➔ aterosclerosi), con conseguente esposizione locale di fattori in grado di attivare repentinamente fenomeni coagulativi. L’i. miocardico predilige i soggetti in età matura o presenile, e con fattori di rischio cardiovascolare, tra cui l’ipertensione arteriosa, il diabete mellito, l’ipercolesterolemia, l’obesità, il fumo di sigaretta, la familiarità per cardiopatia ischemica.
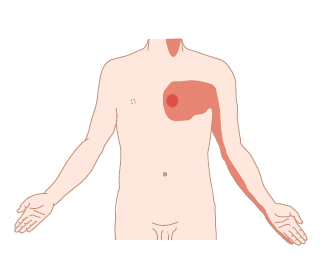
Il quadro clinico che ne deriva varia a seconda del distretto circolatorio interessato dalla lesione coronarica, potendo interessare arterie di piccolo calibro o arterie di calibro maggiore deputate alla vascolarizzazione di ampie zone di miocardio che forniscono un contributo essenziale alla funzione di pompa del cuore (come per es., nel caso dell’occlusione del tronco comune o del ramo discendente anteriore della coronaria sinistra). Il sintomo dominante è il dolore retrosternale intenso e duraturo, tipicamente descritto come un ‘peso’ o una ‘morsa’, per lo più irradiato al braccio sinistro e al collo (v. fig.). Non di rado il dolore viene descritto come epigastrico, potendo così essere erroneamente interpretato come di origine gastrica (gastriti, esofagiti, spasmo esofageo). Possono essere presenti segni e sintomi imputabili a un quadro clinico di bassa portata cardiaca, caratterizzato da ipotensione, sudorazione profusa, difficoltà nel respiro, sino alla perdita di conoscenza. Nel caso di un i. particolarmente esteso, l’esordio può essere caratterizzato dalla sincope (➔) o dalla morte improvvisa, che occorre a seguito di aritmie come la fibrillazione ventricolare.
La diagnosi di i. del miocardio si avvale del contributo dell’elettrocardiogramma (ECG) e di analisi ematiche in grado di rilevare nel sangue la presenza di ‘marcatori’ di necrosi delle cellule miocardiche (troponina, mioglobina, isoenzima MB della CK, ALT, AST, LDH). Significato decisivo sul piano diagnostico, terapeutico e prognostico, ha la comparsa di alterazioni elettrocardiografiche tipiche, diverse a seconda della tipologia, della sede e dello stadio evolutivo dell’infarto. La moderna classificazione individua infatti sulla base del tracciato ECG due principali tipologie di i. miocardico, definite STEMI e NSTEMI (dall’ingl. ST Elevation Myocardial Infarction e Non-ST Elevation Myocardial Infarction), che prevedono un diverso inquadramento clinico e un diverso trattamento.
Il moderno trattamento dell’i. del miocardio consiste nell’angioplastica coronarica, procedura mediante la quale l’ostruzione dell’arteria coronarica viene raggiunta da un catetere introdotto per via arteriosa periferica e dilatata con appositi ‘palloncini’ muniti di piccole reti metalliche in grado di garantire nel lungo periodo la pervietà del vaso. La terapia medica nella fase acuta si avvale inoltre di farmaci ad azione antiaggregante e anticoagulante, nitrati e betabloccanti. La prognosi è legata alla tempestività con cui si risolve l’ostruzione a livello del vaso coronarico (tempo precoronarico), riportando ossigeno al muscolo cardiaco, e alla possibilità che nella fase acuta si sviluppino complicanze meccaniche (come la rottura di cuore) o aritmiche (come la tachicardia ventricolare e la fibrillazione ventricolare). Tempi precoronarici lunghi comportano una maggior sofferenza ischemica del miocardio e una maggior quota di tessuto muscolare che verrà irrimediabilmente perduta. Tale tessuto evolverà istologicamente in tessuto di riparazione cicatriziale, inerte da un punto di vista elettrico e contrattile, con la conseguente evoluzione in insufficienza cardiaca e la comparsa di aritmie cardiache anche fatali.
I. cerebrale e midollare
L’i. cerebrale è causato dall’ostruzione di un’arteria cerebrale (➔ ictus). Il quadro clinico dipende dalla perdita di funzione delle parti del cervello che vengono irrorate dal vaso ostruito; per cui è importante stabilire il livello esatto dell’ostruzione. Variazioni, anche ampie, del quadro clinico dipendono dalla presenza o meno di anastomosi arteriose e anche dalla variabilità di distribuzione delle arterie.
L’i. midollare deriva dall’ostruzione dell’arteria spinale anteriore o da emboli provenienti da placche ateromatose dell’aorta.