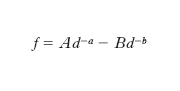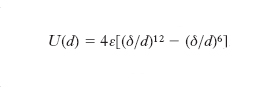intermolecolari, forze
Il complesso di forze di tipo attrattivo e repulsivo a cui danno luogo, pur mantenendo la propria individualità chimica, due molecole o ioni o atomi dello stesso o di diverso tipo quando si trovano a una certa distanza (distanza intermolecolare). Diversa è la situazione che si genera quando tra molecole o ioni o atomi si stabiliscono interazioni che determinano la comparsa di nuove specie stabili: si ha in questo caso la formazione di veri e propri legami chimici. Per quel che riguarda l’interazione intermolecolare a breve distanza, essa è sempre repulsiva e impedisce la deformazione della struttura molecolare.
La rappresentazione analitica delle forze di interazione repulsiva non è del tutto definita; comunque esse diminuiscono con la distanza intermolecolare d secondo potenze maggiori di 7: ciò significa che la loro azione è significativa solo a distanze molto piccole (dell’ordine dei raggi atomici) giustificando la denominazione spesso usata di forze a corto raggio. Le azioni attrattive di natura elettrostatica sono sensibili per valori relativamente grandi della distanza intermolecolare; per gli ioni prevale di gran lunga la forza coulombiana che varia con l’inverso del quadrato della distanza in modo tale che l’interazione tra ioni è notevole anche a grandi distanze. Per le molecole neutre, invece, l’attrazione è significativa a distanze inferiori ed è generata da interazioni di tipo dipolare. Nel loro insieme tali interazioni prendono il nome di forze di van der Waals. Precisamente, se si considerano molecole polari, dotate cioè di un momento intrinseco di dipolo elettrico, tra esse si esercita una mutua azione di orientamento tendente ad allineare i momenti elettrici.
Se si considerano, invece, molecole non polari in presenza di molecole polari, il campo elettrico generato da queste ultime polarizza le prime che acquistano un momento di dipolo elettrico. P.J. Debye ha dimostrato che il momento indotto nella seconda molecola è orientato in modo da favorire una interazione di tipo attrattivo (forze di induzione o di Debye). Nel caso di molecole o atomi privi di momento dipolare permanente, l’attrazione è determinata esclusivamente dalla forza di dispersione o di London la quale si genera dalla distribuzione istantanea, non simmetrica degli elettroni attorno ai nuclei da cui deriva l’esistenza di un momento di dipolo elettrico istantaneo: il valore medio dell’interazione tra questi momenti non è nullo anche se i momenti stessi sono a valore medio nullo. In questo caso la forza di interazione è usualmente rappresentata mediante la relazione:
con A e B costanti e positive e a e b interi positivi, dove il primo termine, positivo, rappresenta le interazioni repulsive mentre il secondo, negativo, quelle attrattive. Poiché si è osservato che le interazioni repulsive decrescono molto più rapidamente (in valore assoluto) di quelle attrattive, risulta che a > b. Determinazioni sperimentali condotte su sistemi gassosi (in particolare, misure di viscosità) e solidi (in particolare, determinazioni dell’assetto di equilibrio di sistemi cristallini) mostrano che i valori di a e b dipendono dal tipo di molecola. Nel caso di molecole sferiche si è ottenuto a=13 e b=7. In accordo con tali valori è la formula di Lennard-Jones dell’energia potenziale intermolecolare:
,
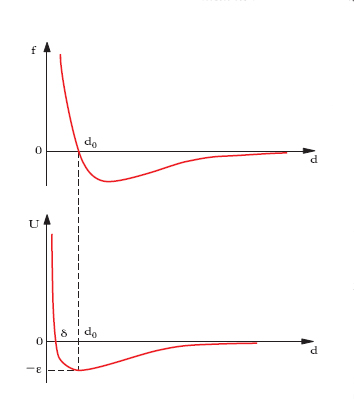
essendo ε e δ due opportune costanti che rappresentano rispettivamente il valore minimo (cambiato di segno) dell’energia potenziale di interazione e la distanza intermolecolare alla quale l’energia potenziale è nulla. L’andamento di f e di U in funzione di d secondo queste relazioni è schematizzato in fig.
Come si vede, vi è un ben definito valore d0 cui corrisponde l’energia potenziale minima e l’equilibrio tra la forza di interazione repulsiva, a corto raggio, e quella attrattiva, a lungo raggio: in effetti a d0 corrisponde la posizione intorno alla quale oscillano le molecole nel moto di agitazione termica.