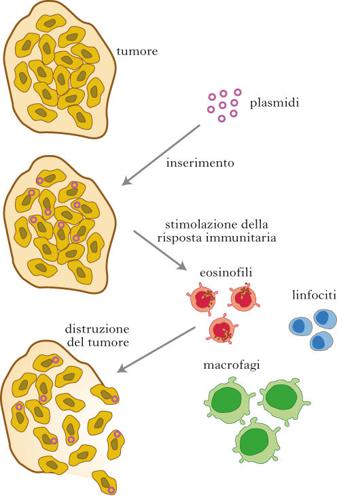
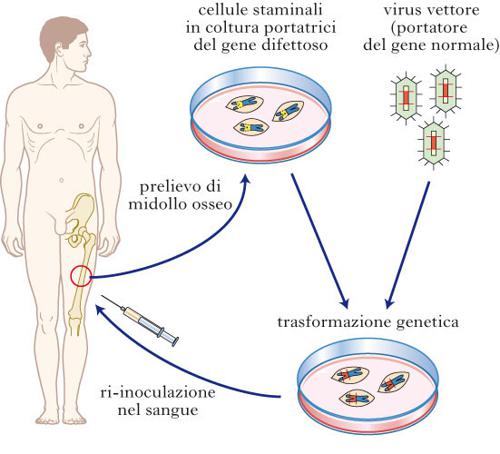
terapìa gènica
terapìa gènica Trattamento che consiste nel sostituire un gene difettoso dal punto di vista funzionale con uno normale. La base tecnica della t.g. consiste nell'introduzione di geni, precedentemente inseriti in opportuni vettori (plasmidi, virus), in appropriate cellule del paziente. I tentativi sperimentali di applicazione della t.g. in diverse aree biomediche (per es. oncologia e infettivologia) hanno portato alla ridefinizione e all'espansione del termine, che ora indica tutti i trattamenti che determinano alterazioni genetiche delle cellule.
approfondimento di Antonio Fantoni
Le malattie ereditarie sono provocate da geni mutati, con funzioni alterate, che vengono trasferiti dai genitori ai figli come materiale genetico contenuto nei gameti. Il gene mutato può alterare le funzioni cellulari in due modi, sia producendo una proteina incapace di svolgere la funzione necessaria alla vita cellulare e quindi dell'organismo, sia dando origine a una proteina con una funzione dannosa per l'organismo stesso. Il primo tipo di gene mutato si definisce recessivo, perché sia il gene paterno sia quello materno devono essere mutati per dare completa assenza di funzione. Il secondo tipo di mutazione si definisce invece dominante, perché basta che uno dei due geni ricevuti dai genitori sia divenuto dannoso per provocare la malattia. La terapia genica consiste nel restaurare la funzione normale correggendo il gene mutato, cioè introducendo nel genoma dell'organismo malato il gene normale. Nelle malattie da mutazione recessiva viene introdotto nelle cellule alterate il gene capace di produrre quantità sufficienti di proteina normale, mentre nelle patologie dovute a geni dominanti la terapia deve inattivare il gene mutato, in modo da impedirgli di produrre la proteina dannosa.
La terapia genica delle cellule germinali
In via del tutto teorica, ma per ora impraticabile, la terapia genica dovrebbe esercitarsi sul pre-embrione, cioè sulle primissime cellule originate dopo l'incontro dei patrimoni genetici paterno e materno. In questo modo, potrebbe essere corretto il genoma dell'intero organismo e quindi la terapia risulterebbe pienamente efficace non solo per il paziente, ma anche per la discendenza. Tuttavia questa tecnologia, ampiamente sperimentata negli animali transgenici dal 1982 e sicuramente praticabile anche nell'uomo, negli animali sperimentali dimostra un'efficienza molto bassa e, comportando alti rischi di ulteriori danni genetici per il feto, è proibita dalle attuali legislazioni.
Terapia genica somatica
L'unica terapia genica già oggi in uso è quella genica somatica (fig.) che non riguarda la linea germinale, ma che è capace di modificare direttamente il DNA genico dei tessuti colpiti dalla patologia, cioè delle cellule dove la proteina prodotta dai geni mutati è inattiva o dannosa all'organismo. A questo scopo viene utilizzata una biotecnologia sostitutiva, che introduce nel tessuto patologico il gene normale veicolato da un virus innocuo per l'uomo. Il gene umano viene legato al genoma di un virus chiamato vettore, spesso un adenovirus, che ha la capacità di riconoscere in modo specifico le cellule bersaglio, di introdurvi il suo genoma (compreso il gene umano) e di riprodursi in modo da 'infettare' poi altre cellule, diffondendo così la presenza del gene umano normale e quindi provocando l'effetto terapeutico.
Questa procedura è di più facile attuazione quando il tessuto colpito è il sangue. In questo caso le cellule bersaglio possono essere quelle staminali, prelevate dal paziente, infettate con il virus in provetta e poi reiniettate in vena. In questo modo a partire dal 1992 sono stati trattati bambini affetti da SCID, una grave immunodeficienza ereditaria dovuta alla mutazione di un gene necessario per la produzione di anticorpi nei globuli bianchi immunocompetenti. Il successo è stato molto parziale, perché solo poche cellule staminali sono state infettate dall'adenovirus vettore del gene normale e inoltre perché l'effetto del gene stesso decresce progressivamente.
Le criticità della terapia genica
Gli insuccessi hanno messo in luce i problemi insiti nella terapia genica somatica. Questi sono essenzialmente di tre tipi. Innanzitutto la proteina normale neosintetizzata, benché endogena degli organismi sani, è ovviamente estranea all'organismo portatore della mutazione e, appena prodotta, viene attaccata in quanto antigene e rimossa dagli anticorpi del paziente. Inoltre, il virus vettore non si inserisce permanentemente nel genoma delle cellule in cui è entrato e quindi viene diluito dalla normale proliferazione cellulare. In più il virus vettore è capace di integrare il gene normale nei cromosomi delle cellule patologiche, ma occasionalmente questo inserimento avviene in corrispondenza di un altro gene cellulare, che viene a sua volta danneggiato. Quest'ultima situazione si è verificata in Francia, proprio in tentativi di terapia per bambini SCID che si sono ammalati di leucemia perché erano stati mutati alcuni oncogeni specifici dei globuli bianchi. Infine, il virus riesce a veicolare il gene terapeutico solo nelle cellule in attiva riproduzione e risulta inattivo su cellule quiescenti, come tessuti muscolari, cellule della retina e del sistema nervoso, peraltro sede di molte malattie ereditarie.
Metodologie di terapia genica in sperimentazione
Negli anni 2002-06 sono stati sperimentati nuovi metodi che utilizzano biotecnologie di recente scoperta, capaci di ridurre alcuni dei problemi sopra riportati. Per essere sicuri di veicolare il gene terapeutico in segmenti del genoma ospite non pericolosi si sono usati vettori virali quali parvovirus, ospiti abituali e non patogeni dell'uomo, in grado di inserirsi sempre in un tratto specifico del cromosoma 19, ben tollerati dal sistema immunitario e in grado di infettare anche cellule del sistema muscolare e nervoso. Sono stati studiati strumenti chimici e meccanici capaci di far penetrare il DNA genico direttamente come tale nei tessuti da trattare, per es. utilizzando i liposomi, micelle che formano con il DNA complessi capaci di essere veicolati per endocitosi attraverso la membrana cellulare e di proteggere dalla distruzione il DNA penetrato, permettendone così una azione prolungata. Le capacità di particolari molecole di RNA (RNA antisenso, micro RNA) di regolare l'espressione genica si sono dimostrate preziose per bloccare l'azione di oncogeni in tessuti tumorali, per riprogrammare cloni di cellule immunitarie specifiche per il gene terapeutico, in modo da abolirne il rigetto. Infine, questi RNA si stanno dimostrando preziosi per bloccare l'azione di geni mutati ad azione dominante, come nel caso del morbo di Huntington.