adsorbimento
Fenomeno in virtù del quale la superficie di una sostanza solida, detta adsorbente, fissa molecole provenienti da una fase gassosa o liquida con cui è a contatto (per superficie si deve intendere non solo quella esterna ma anche quella ‘interna’ dei canalicoli capillari, delle fratture ecc.). L’a. è un fenomeno spontaneo e quindi è accompagnato da una diminuzione dell’energia libera del sistema. Inoltre, poiché una molecola adsorbendosi diminuisce i suoi gradi di libertà, l’a. è accompagnato da una diminuzione di entropia. I processi di a. sono esotermici. Il calore sviluppato nell’a. di una mole è chiamato calore di adsorbimento.
L’a. può essere di due tipi, fisico o chimico a seconda che entrino in gioco forze di attrazione molecolare (forze di Van der Waals) oppure ordinarie forze di valenza. L’a. fisico ha luogo con uno sviluppo di calore relativamente basso, e il processo si svolge con alta velocità. L’a. chimico, invece, è accompagnato da elevato sviluppo di calore e avviene con velocità non sempre elevate poiché si tratta di un processo che richiede il superamento di una barriera di energia di attivazione. Nell’a. fisico il calore d’a. è dello stesso ordine di grandezza del calore di condensazione, e ammonta a qualche migliaio di joule per mole; nell’a. chimico si possono avere invece sviluppi di calore dell’ordine di 10.000-100.000 joule per mole. Poiché le forze fisiche non dipendono dalla natura specifica delle sostanze a contatto, l’a. fisico ha sempre luogo, mentre quello chimico si sovrappone al precedente solo quando si manifestano le interazioni di legame. A. fisico Si può formare un unico strato di molecole sino a saturare la superficie o più strati sovrapposti uno all’altro. Per un dato gas o vapore e per una massa unitaria di un dato adsorbente, il volume v di gas adsorbito all’equilibrio è funzione solo della pressione p e della temperatura T. Quando la pressione del gas viene variata a temperatura costante, la funzione v = f (p; T = cost.) descrive la cosiddetta isoterma di adsorbimento.
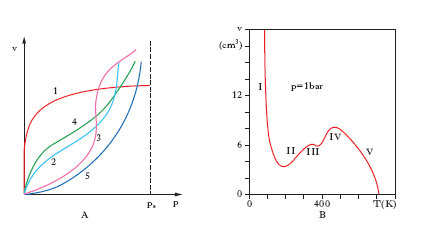
In fig. A sono riportati gli andamenti sperimentali tipici delle isoterme di a. per i gas (1 e 2) e i vapori (3, 4 e 5); ps indica la pressione di saturazione, che per i vapori coincide generalmente con la pressione di vapor saturo. Per descrivere l’andamento delle isoterme di a. sono state proposte varie equazioni tra cui le più importanti sono: a) l’isoterma di Langmuir, valida per l’a. unimolecolare, è del tipo v = p/(ap + b), dove a e b sono due costanti che si possono calcolare con i metodi della meccanica statistica; l’equazione prevede che alle alte pressioni il volume di gas o vapore adsorbito raggiunga un valore di saturazione; b) l’isoterma di Freundlich è del tipo v = Kpn, dove K e n sono costanti empiriche, e trova largo impiego nella pratica; c) l’isoterma di Brunauer, Emmet e Teller descrive molto bene l’a. multimolecolare dei vapori: v = ax/(1 − x) · (1 − bx) dove x = p/ps e a, b sono due costanti determinabili per mezzo della meccanica statistica.
A. chimico Può essere considerato come una reazione chimica tra gli atomi o le molecole della superficie dell’adsorbente e le molecole della sostanza adsorbita. Può venire evidenziato studiando un’isobara di a.; in fig. B è riportata l’isobara sperimentale di a. di idrogeno su ossido di zinco: la prima porzione discendente (I) della curva corrisponde all’a. fisico mentre le altre due porzioni discendenti (III e V) corrispondono a due differenti tipi di a. chimico caratterizzati da due diverse reazioni. Poiché l’a. chimico è un processo esotermico il volume adsorbito dovrebbe sempre decrescere all’aumentare della temperatura: il fatto che l’isobara di a. presenti porzioni (II, IV) nelle quali è crescente si interpreta ammettendo che in queste porzioni i punti sperimentali non siano punti di equilibrio e che la velocità di a. chimico aumenti con la temperatura. L’a. chimico è sempre unimolecolare, quindi le isoterme di a. tendono a una saturazione e sono bene rappresentate dalle equazioni di Langmuir e di Freundlich. In alcuni casi i risultati sperimentali sono ben rappresentati dall’isoterma di Temkin la cui equazione è del tipo lnp = A + Bv, dove A e B sono due costanti. L’a. chimico non è istantaneo, come quello fisico, e l’equilibrio può venir raggiunto anche dopo ore; la velocità di chemiadsorbimento cresce esponenzialmente con la temperatura e quindi si può definire una energia di attivazione. L’a. chimico ha grandissima importanza nei processi di catalisi eterogenea in cui la reazione chimica ha luogo sulla superficie del catalizzatore; almeno uno dei reagenti deve venire adsorbito prima che abbia inizio la reazione e la velocità di a. può determinare la velocità della reazione.
L’a. trova molte applicazioni industriali nella deumidificazione dell’aria o di altri gas a pressione sia atmosferica sia a essa superiore (condizionamento dell’aria, essiccazione di cibi a bassa temperatura, preparazione di atmosfere controllate in forni metallurgici ecc.); altre applicazioni si hanno nel ricupero di solventi volatili, nelle maschere di protezione contro gas tossici, per la depurazione di acque inquinate. Particolari utilizzazioni dell’a. si hanno nell’analisi cromatografica. Industrialmente l’a. si applica in due modi: in sistemi a percolazione (dove il fluido da cui si devono asportare uno o più componenti passa su uno strato fisso di materiale adsorbente granulare) o a contatto (dove le fini particelle d’adsorbente sono mantenute in sospensione nel fluido, dal quale si separano, per es. per filtrazione, dopo sufficiente durata del contatto). Naturalmente l’adsorbente dopo un certo periodo si esaurisce, cioè perde la sua capacità d’a. e deve essere rigenerato o riattivato, ciò che di solito si può ottenere facendo passare sull’adsorbente vapore o gas caldo.