antiossidanti
Biologia
Enzimi o molecole più semplici in grado di contrastare l’azione lesiva dei radicali liberi contenenti ossigeno, e di esercitare pertanto un’azione protettiva sull’integrità cellulare. Si distinguono in primari, o preventivi, la cui funzione è quella di impedire o ritardare l’ossidazione tramite rimozione o inibizione dell’agente ossidante, e secondari, la cui funzione è di interrompere l’ossidazione una volta iniziata.
Meccanismi d’azione
Durante una reazione ossidativa l’a. può diminuire la concentrazione locale di ossigeno, sia per combinazione, sia per allontanamento; prevenire l’inizio dell’ossidazione rimuovendo i radicali iniziatori, quali il radicale idrossile (•OH); legare i metalli (soprattutto ferro e rame) e mantenerli in forme che non siano in grado di generare radicali liberi (quali il radicale idrossile o il perferrile) o di decomporre perossidi lipidici in forme radicaliche (quali i radicali perossile e alcossile); convertire i perossidi in forme non radicaliche, come, per es., gli alcoli; interrompere la catena ossidativa rimuovendo radicali intermedi come i radicali perossili o gli alcossili e impedendo quindi il proseguimento della reazione. Gli a. che agiscono secondo i primi quattro meccanismi sono primari, mentre appartengono agli a. secondari quelli che agiscono secondo l’ultimo meccanismo. Gli a. secondari sono costituiti in genere da piccole molecole che reagiscono con i radicali liberi trasformandoli e trasformandosi in altri composti non radicalici. I requisiti fondamentali di tali a. sono: alta costante di reazione con l’agente ossidante; trasformazione, in seguito a reazione con le specie ossidanti, in prodotti non radicalici o in prodotti a emivita più lunga, con minore carica ossidante. In genere un a. svolge la sua azione in sinergia con altre sostanze antiossidanti. Gli a. catturano l’elettrone spaiato ad alta energia della specie radicalica ossidante, trasformandosi essi stessi in un radicale, ma con minore forza ossidante. Possono poi trasferire l’elettrone a un’altra molecola a. e trasformarsi in un radicale sempre meno reattivo (quindi con vita media più lunga fino allo ‘spegnimento’ completo, o quenching, della carica radicalica). I più importanti e conosciuti a. nei fluidi biologici, sono, l’acido ascorbico (vitamina C) e l’α-tocoferolo (vitamina E). Nessun a., da solo, è in grado di conferire un’efficace protezione alle sostanze ossidabili, soprattutto per tempi prolungati. La resistenza di una soluzione alle reazioni di ossidazione può essere efficacemente valutata con la misura della sua capacità antiossidante che si può ottenere mediante diversi metodi: TRAP (total radical-trapping antioxidant parameter), TEAC (trolox equivalent antioxidant capacity), ORAC (oxygen radical absorbance capacity). Il valore ottenuto esprimerà la capacità che la soluzione in esame ha di resistere a una perossidazione lipidica artificialmente indotta e controllata in laboratorio. Il risultato è espresso in valori assoluti (moli di radicali perossilici intrappolati da un dato volume di soluzione) o relativi alla capacità a. di un a. noto. Rispetto alla misura delle concentrazioni dei singoli a., la misura della capacità a. totale è un parametro che tiene conto della quantità di a. presenti, delle loro sinergie e della presenza di ossidanti.
Aspetti biochimici e fisiologici
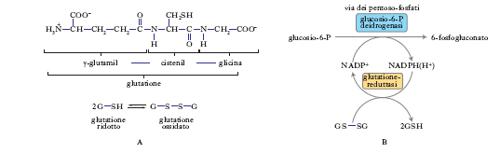
Tutti gli organismi aerobi, e l’uomo in particolare, hanno sviluppato eccellenti sistemi di difesa a., che consistono in a. enzimatici e in molecole più semplici di provenienza nutrizionale. Gli a. enzimatici si distinguono in: a) superossido-dismutasi (fig. 1A), che trasformano l’anione superossido (la prima delle specie reattive dell’ossigeno, che si forma nel corso dell’autossidazione di vari substrati nel mitocondrio durante il trasporto elettronico) in ossigeno molecolare e acqua ossigenata, prodotto ancora dotato di una discreta capacità ossidante, ma non radicale e dotato di maggiore stabilità; b) catalasi (fig. 1B), che trasformano l’acqua ossigenata in acqua e ossigeno, completando quindi il lavoro delle superossido-dismutasi; c) glutatione-perossidasi (fig. 1C), che trasformano i perossidi in sostanze non ossidanti utilizzando il glutatione. Gli a. non enzimatici sono invece costituiti da molecole di basso peso molecolare, provenienti dal cibo assunto, principalmente da alimenti vegetali o derivati. Gli a. enzimatici sono inducibili: qualora l’organismo sia sottoposto a un carico di specie ossidanti superiore, reagirà producendo maggiori quantità di enzimi antiossidanti. Tale meccanismo è alla base dell’effetto benefico di un’attività sportiva moderata e regolare. Durante l’esercizio fisico, infatti, l’organismo è sottoposto a un carico radicalico maggiore sia per aumentato consumo di ossigeno, sia per fenomeni di ischemia e riperfusione a livello muscolare. Ciò stimolerà le cellule a una maggiore produzione di enzimi a. per far fronte all’aumentato carico. Durante le fasi di riposo l’organismo avrà a disposizione maggiori difese antiossidanti. I livelli di tali enzimi, in particolare delle superossido-dismutasi, sono particolarmente importanti per la protezione dai danni da radicali, tanto da essere direttamente correlati con la lunghezza media della vita delle differenti specie animali. Una cellula combatte gli insulti ossidativi, oltre che in maniera enzimatica, anche tramite molecole a. quali acido ascorbico, tocoferoli, carotenoidi, polifenoli ecc. Queste sostanze operano il quenching del radicale a spese del glutatione, tripeptide ubiquitario sintetizzato dall’organismo. Arrivata al glutatione, la catena ossidativa perde la carica radicalica. Il glutatione ossidato viene rigenerato metabolizzando il glucosio attraverso la via dei pentoso-fosfati (fig. 2A e B). L’importanza che tale meccanismo ha nella protezione a. appare evidente nelle patologie correlate all’incapacità della cellula di rigenerare il glutatione.
Impieghi preventivi e terapeutici
Molte malattie croniche tra cui aterosclerosi e neoplasie maligne riconoscono come meccanismo patogenetico di base un aumentato stress ossidativo. Questa situazione è dovuta alla perdita del normale equilibrio tra carico di radicali liberi e difese antiossidanti. Un’alimentazione ricca di frutta e verdura sembra in grado di proteggere da tali malattie per il suo alto contenuto di sostanze antiossidanti. Nei prodotti ortofrutticoli oltre ad acido ascorbico, α-tocoferolo, β-carotene sono presenti sostanze, comunemente raggruppate col nome generico di polifenoli, che comprendono migliaia di molecole diverse, con funzioni e strutture chimiche differenti. I polifenoli sono in grado di agire come a. primari, legando i metalli, inoltre inibiscono alcuni enzimi chiave della cascata dell’acido arachidonico e dell’infiammazione. Un maggiore consumo alimentare di ortofrutticoli si traduce in esposizione a un minore carico di sostanze perossidate o comunque ossidanti, oltre che in un maggior apporto di a. e di fibre e conseguentemente in una maggiore protezione dell’organismo nei riguardi dello stress ossidativo.
Chimica
Sostanze capaci, anche se presenti in piccola quantità, di ritardare o inibire i processi di ossidazione di materiali degradabili. Gli a. trovano largo impiego nell’industria degli alimenti, degli elastomeri, delle materie plastiche, dei saponi, dei lubrificanti, dei cosmetici, dei prodotti farmaceutici, dei derivati del petrolio. L’autossidazione dei materiali organici può portare, a seconda dei casi, a rottura della catena idrocarburica, a insaturazione, a formazione di gruppi funzionali ossigenati (idroperossidi ecc.), a formazione di frammenti a basso peso molecolare, con conseguente deterioramento delle proprietà originarie dei materiali. Le reazioni che sono alla base di tutti i processi ossidativi sopra descritti sono reazioni radicaliche e il compito degli a. consiste appunto nel cercare di impedire o perlomeno di ritardare il procedere di queste reazioni. Gli a. impiegati industrialmente possono essere suddivisi in quattro classi fondamentali: inibitori, decompositori di idroperossidi, fotostabilizzanti e disattivatori metallici. Gli inibitori agiscono interrompendo la propagazione della catena di reazioni ossidative, sostituendosi al prodotto da preservare e venendo essi stessi ossidati. Gli inibitori più comuni sono composti di tipo fenolico. I decompositori di idroperossidi agiscono provocando la scissione degli idroperossidi, intermedi indispensabili del processo ossidativo che viene così bloccato. I fotostabilizzanti agiscono bloccando le radiazioni ultraviolette della luce solare che potrebbero provocare la formazione iniziale degli idroperossidi. I disattivatori metallici, infine, complessano le impurezze metalliche contenute nelle sostanze da proteggere, impedendo la formazione del complesso metallo-idroperossido.