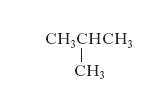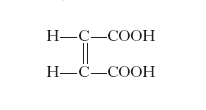isomeria
Chimica
Fenomeno per il quale due o più composti chimici aventi proprietà diverse hanno la stessa formula grezza ma diversa formula di struttura, oppure hanno la medesima formula di struttura ma diversa configurazione spaziale. Tali composti vengono chiamati isomeri.
Generalità
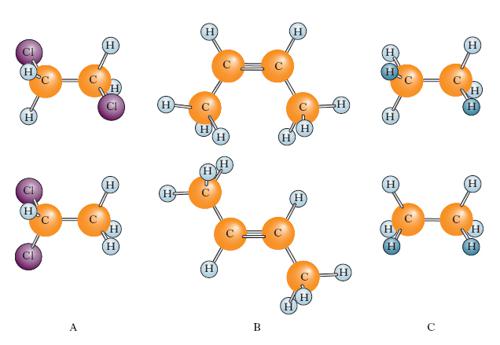
L’isomeria è particolarmente frequente nei composti organici e in special modo in quelli a elevato numero di atomi di carbonio: per es., per l’idrocarburo della serie del metano di formula C13H28 possono esistere 802 isomeri, tanti quante sono le possibili disposizioni geometriche secondo le quali i 13 atomi di carbonio possono unirsi nella catena. Si distinguono diversi tipi di i.: i. di struttura (fig. A), per la quale gli isomeri differiscono per le diverse relazioni di adiacenza tra gli atomi delle molecole: tali relazioni riguardano la struttura dello scheletro idrocarburico (i. di catena), la posizione dei sostituenti (i. di posizione), la struttura del gruppo funzionale (i. di funzione); stereoisomeria (fig. B), per la quale gli isomeri, detti in questo caso anche stereoisomeri, hanno la stessa formula di struttura ma differiscono per la posizione relativa assunta nello spazio da alcuni degli atomi dei gruppi atomici che li costituiscono. La stereoisomeria è dovuta alla presenza di atomi chirali nella molecola.
I. di struttura
I. di catena
È presentata dai composti alifatici e ciclo-alifatici ed è dovuta alle diverse possibili disposizioni che gli atomi di carbonio assumono nella catena o nell’anello: esempi di questo tipo di i. sono il butano, CH3CH2CH2CH3, e l’isobutano (v. formula)
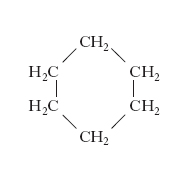
l’alcol amilico, CH3CH2CH2CH2CH2OH, e quello isoamilico, (CH3)2CHCH2CH2OH; il cicloesano (v. formula)
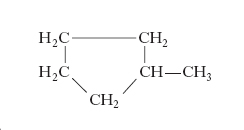
e il metilciclopentano (v. formula)
I. di posizione
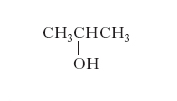
È dovuta alla diversa posizione che un sostituente può occupare nella struttura degli atomi di carbonio o alle posizioni relative occupate da due o più sostituenti: esempi di questo tipo di i. sono l’alcol propilico primario CH3CH2CH2OH e quello secondario (v. formula)
il metilpropilchetone CH3COCH2CH2CH3 e il dietilchetone CH3CH2COCH2CH3, gli isomeri orto-, meta- e para- aromatici, la chinolina ecc.
I. di funzione
Per essa sono isomeri l’aldeide propionica CH3CH2CHO e l’acetone CH3COCH3, l’alcol etilico CH3CH2OH e l’etere dimetilico CH3OCH3 ecc.
I. di nucleo
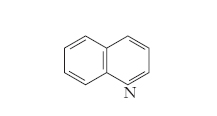
Presentata dai composti eterociclici, è dovuta alla diversa posizione che l’eteroatomo o gli eteroatomi assumono nell’anello, come nel caso della chinolina (v. formula)
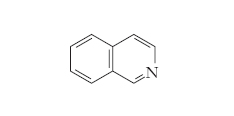
e l’isochinolina (v. formula)
Quando due isomeri di posizione si convertono più o meno rapidamente l’uno nell’altro, dando luogo a una situazione di equilibrio dinamico in cui coesistono entrambe le forme isomeriche anche se in diverse quantità, si verifica la tautomeria (o i. dinamica). In tali casi a un composto competono entrambe le formule di struttura che rappresentano le forme tautomere. Questo tipo di i. comporta solitamente lo spostamento di un atomo, meno spesso di un intero aggruppamento; l’atomo che determina più frequentemente la tautomeria è quello dell’idrogeno, più mobile degli altri a causa delle sue ridotte dimensioni. In taluni casi, la velocità di conversione è abbastanza lenta da permettere di isolare le forme isomere (desmotropia); altre volte l’equilibrio è spostato quasi completamente verso una delle due forme e soltanto quando il composto reagisce hanno luogo derivati provenienti dall’altra forma tautomera (pseudomeria). La conversione di un isomero nell’altro e l’equilibrio tra le varie forme dipendono essenzialmente dalle condizioni di reazione per cui non c’è differenza di principio tra i vari tipi di i. di posizione; infatti, sostanze semplicemente isomere a temperatura ordinaria possono diventare tautomere a temperature superiori aumentando la velocità di isomerizzazione: così avviene, per es., in molti casi di racemizzazione. L’esempio più noto di tautomeria è rappresentato dall’estere acetoacetico al quale, in base a certe reazioni da esso presentate, si dovrebbe assegnare la formula CH3COH=CHCOOC2H5 e in base ad altre la formula CH3COCH2COOC2H5.
Stereoisomeria
I. geometrica
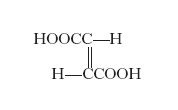
È presentata dai composti non saturi ed è dovuta alla posizione relativa assunta nello spazio dagli atomi o radicali legati ai due atomi di carbonio o di carbonio e azoto ecc., uniti da un doppio legame; esempi di questo tipo di i. sono dati dall’acido fumarico (v. formula)
e dall’acido maleico (v. formula)
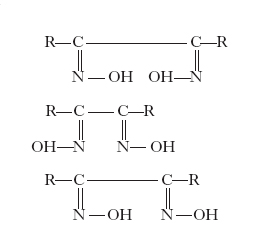
(i. cis e trans), dalle monossime (i. sin e anti), dalle diossime (v. formula)
(i. sin, anti e anfi) ecc. Gli i. geometrici non si convertono spontaneamente l’uno nell’altro a temperatura ordinaria a causa dell’elevata barriera di potenziale, determinata dai legami π nel doppio legame C=C, che impedisce la libera rotazione.
I. ottica (o enantiomeria)
Per l’i. ottica due composti simili in tutte le proprietà fisiche e chimiche differiscono soltanto perché uno devia il piano della luce polarizzata in un senso (per es., verso destra) e l’altro in senso opposto e di un uguale numero di gradi. I due isomeri, detti rispettivamente destrogiro e levogiro, prendono il nome di antipodi ottici. Questo tipo di i. è caratterizzato dalla presenza di un atomo di carbonio asimmetrico (carbonio chirale); nel modello tetraedrico, l’atomo di carbonio, posto al centro di un tetraedro, ha le valenze saturate da atomi, o gruppi atomici, occupanti i vertici del tetraedro stesso; se i 4 atomi, o gruppi atomici, sono differenti fra loro (atomo di carbonio asimmetrico), il modello tetraedrico rende ragione dell’esistenza di due configurazioni spaziali non sovrapponibili, che sono l’una l’immagine speculare dell’altra. Così esistono due acidi lattici enantiomeri (acido D-lattico e acido L-lattico) nelle cui molecole c’è un atomo di carbonio legato a quattro gruppi diversi (a un atomo di idrogeno, a un gruppo ossidrilico, a un gruppo metilico e a un gruppo carbossilico). Invece che di carbonio, l’atomo che nell’edificio molecolare viene a costituire un centro di asimmetria può essere di silicio, di zolfo, di fosforo ecc., anche se i corrispondenti isomeri sono molto più rari in natura.
Quando i due antipodi ottici sono presenti in quantità uguali, l’effetto del loro potere rotatorio si annulla a vicenda e si ha allora una miscela racemica, che sempre si ottiene quando si prepara per sintesi un composto che presenta i. ottica. A causa della loro identità chimica gli enantiomeri sono separabili solo con metodi particolari, per es. trasformandoli in derivati diastereoisomeri tra loro e, dopo la separazione, ripristinando gli enantiomeri di partenza. Per contraddistinguere due enantiomeri (nel caso dei composti poliossidrilati, come gli esosi, o degli amminoacidi) si usano come prefissi le lettere D e L, a seconda che il composto sia derivabile dalla D- o dalla L-gliceraldeide. Inoltre si possono premettere al nome i simboli (+) e (−) per indicare l’isomero destrogiro (un tempo designato con d-) e quello levogiro (un tempo designato con l-); la configurazione assoluta è invece indicata dai prefissi R e S. Quasi sempre in natura si trova solo una delle due possibili forme enantiomere: così è diffuso il D-glucosio ma non l’L-glucosio, la L-alanina ma non la D-alanina ecc.
Diasteroisomeria
Per la diasteroisomeria due isomeri differiscono per le configurazioni di due o più atomi di carbonio asimmetrico ma non risultano l’uno l’immagine speculare dell’altro. I diasteroisomeri sono otticamente attivi ma con diverso valore assoluto del potere rotatorio specifico; hanno proprietà chimiche simili ma proprietà fisiche diverse e perciò possono essere separati più facilmente degli enantiomeri. Sono diasteroisomeri tra loro gli zuccheri aldoesosi glucosio, mannosio, gulosio, galattosio ecc., caratterizzati da 4 atomi di carbonio asimmetrico.
I. conformazionale (fig. C)
Si riferisce a isomeri (detti conformeri) aventi uguale configurazione ma diversa conformazione. Mentre nelle i. configurazionali per passare da un isomero all’altro è necessaria la rottura di legami chimici, in quella conformazionale tale passaggio si verifica per rotazione attorno al legame semplice C−C. Poiché tale rotazione implica il superamento di barriere di potenziale molto piccole, i conformeri sono caratterizzati da una notevole facilità di interconversione e non è quasi mai possibile separarli. Solo in particolari casi la libera rotazione attorno al legame semplice C−C può essere maggiormente impedita a causa, per es., di un notevole ingombro sterico dei sostituenti; così l’1-terz-butil-cicloesan-1-olo, derivato del cicloesano, a causa della notevole dimensione del gruppo terz-butilico, assume soltanto una conformazione ‘a sedia’. In casi come questi è possibile ottenere isomeri conformazionali praticamente puri.
Isomerizzazione
La reazione chimica attraverso la quale avviene la trasformazione di un composto in un suo isomero è detta isomerizzazione. Particolarmente importanti nell’industria del petrolio sono i processi di isomerizzazione delle paraffine in isoparaffine; i gas provenienti dalle diverse operazioni di raffineria (distillazione atmosferica, cracking catalitico, stabilizzazione delle benzine, coking ecc.) sono trattati in un’unità di frazionamento dove si estraggono, oltre ad altri componenti, anche n-butano, n-pentano e n-esano. L’isomerizzazione del n-pentano e del n-esano dà luogo a isomeri ad alto numero di ottano, usati per carburanti di alta qualità. Molto applicata è l’isomerizzazione del n-butano, in quanto dall’unità di frazionamento non si ottiene una percentuale di isobutano sufficiente per poter essere sottoposta direttamente a un processo di alchilazione (consistente nella reazione di olefine con isobutano al fine di ottenere idrocarburi con numero di ottano molto elevato); per arricchire questa miscela in isobutano si sottopone il butano normale, che invece è contenuto in notevole quantità nella miscela proveniente dalla unità di frazionamento, a un trattamento di isomerizzazione che consiste nel far passare il butano normale sotto pressione (10-25 bar) a temperatura intorno a 100 °C attraverso uno o più reattori contenenti uno strato di tricloruro di alluminio, granulato, in presenza di acido cloridrico gassoso, secco, che funziona da promotore del catalizzatore, oppure utilizzando catalizzatori a base di platino.
Per isomerizzazione dei n- buteni si ottiene i-butene; tale isomerizzazione avviene a temperatura relativamente alta (circa 450 °C), in presenza di catalizzatori acidi. Un’altra reazione di isomerizzazione di interesse industriale riguarda lo spostamento di un gruppo alchilico da una posizione all’altra in un nucleo benzenico. Così nelle miscele di xilene (dimetilbenzene), ottenute per reforming o per cracking a olefine di frazioni petrolifere liquide, l’isomero meta è il più abbondante ma è quello che trova minori impieghi. Con l’isomerizzazione in fase liquida o vapore in presenza di catalizzatore, l’isomero meta si trasforma in quelli orto e para, di maggiore pregio.
Isomerasi
Le isomerasi costituiscono una classe di enzimi responsabili delle reazioni di isomerizzazione. Sono distinte in 5 sottoclassi, i cui componenti catalizzano rispettivamente: le reazioni di trasformazione di uno stereoisomero D o L da una serie all’altra; le isomerizzazioni cis/trans; le ossidoriduzioni (aldosi in chetosi, trasferimento di doppi legami); il trasferimento di gruppi acile, fosforile ecc.; le reazioni di deciclizzazione.
Fisica
I. nucleare
Proprietà di due nuclidi di avere lo stesso numero atomico e lo stesso numero di massa, ma contenuto energetico diverso, in quanto uno di essi si trova in uno stato eccitato nel quale tende a permanere con vita media relativamente lunga (da circa 10−8 s a qualche anno). Transizione isomerica È il processo che porta un nucleo isomero dallo stato eccitato a uno stato di energia inferiore, generalmente quello fondamentale, con emissione di raggi γ o di elettroni di conversione interna.