polarografia
Metodo di analisi chimica di sostanze in soluzione, basato sulla determinazione dei valori assunti dalla corrente elettrica al variare della tensione applicata alla cella di misura.
I polarografi
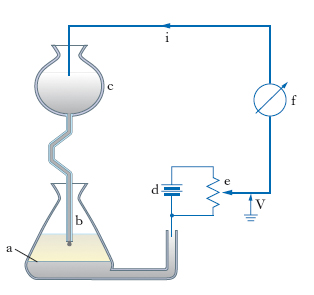
La p. si attua mediante appositi apparecchi, detti polarografi, il cui schema di principio è riportato in fig. 1: la cella, che contiene la soluzione da analizzare, è formata dall’elettrodo di riferimento a, costituito da una larga superficie di mercurio (oppure da un elettrodo a calomelano), e dalla goccia di mercurio uscente da b che costituisce l’altro elettrodo (elettrodo a goccia: il mercurio gocciola, al ritmo di una goccia ogni 3-6 s, affluendo da un tubo flessibile collegato al recipiente c); d è un generatore di tensione continua, e un potenziometro dal cui cursore si preleva la tensione da applicare alla cella, f un galvanometro; i valori della corrente in uscita da f sono resi in forma grafica automaticamente in funzione della tensione (polarogramma).
Procedimento
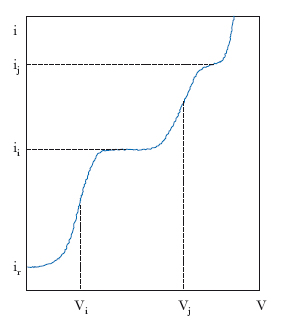
La soluzione in esame, oltre alla specie da analizzare, contiene un sale (elettrolita di supporto) in concentrazione circa 100 volte maggiore di quella della specie da dosare: gli ioni di questo sale hanno il compito di trasportare la corrente nella soluzione (corrente di migrazione). L’analisi si svolge in quiete assoluta, al contrario di quanto avviene comunemente nell’elettrolisi, quando la soluzione esaminata viene agitata vigorosamente; così operando, si annullano gli effetti della convezione sulla corrente totale, non si consente cioè agli ioni di arrivare all’elettrodo utilizzando i moti provocati dall’agitazione. Queste due condizioni – presenza di un elettrolita di supporto e quiete assoluta della soluzione sottoposta a p. – comportano come conseguenza che delle tre componenti della corrente di elettrolisi (corrente di migrazione, corrente di convezione e corrente di diffusione), le prime due sono nulle. La corrente polarografica è, pertanto, soltanto una corrente di diffusione; essa è cioè dovuta alla reazione all’elettrodo di ioni giunti a esso perché è operante un gradiente di concentrazione fra corpo della soluzione, più ricco, e zona elettrodica, più povera, della specie che reagisce all’elettrodo. In regime di diffusione la corrente, pur aumentando la tensione applicata, non può crescere oltre un certo valore (corrente limite di diffusione): da ciò discende che il polarogramma ottenuto è una tipica curva a gradini (fig. 2), in corrispondenza dei quali la corrente subisce un brusco aumento per una piccola variazione di tensione. Ogni gradino (onda polarografica) corrisponde alla reazione di una delle specie ioniche presenti in soluzione; la tensione corrispondente al suo punto di mezzo è il potenziale di semionda (Vi, Vj in fig. 2), caratteristico di ogni specie ionica presente, tanto da permetterne l’identificazione. Il valore raggiunto dalla corrente limite di diffusione (ii, ij; fig. 2) è proporzionale alla concentrazione della specie che reagisce all’elettrodo; su questo fatto si basa l’applicazione della p. all’analisi quantitativa.
Il valore della corrente deve però essere corretto per quella che viene chiamata corrente residua (ir; fig. 2), una corrente apprezzabilmente diversa da zero che passa nella cella anche per valori del potenziale inferiori a quelli necessari per la reazione a carico della specie da dosare.
Tipi di elettrodi
La corrente residua ha due origini: le impurezze presenti nella soluzione e la natura particolare dell’elettrodo a goccia di mercurio che presenta una superficie variabile e periodicamente rinnovata; tale periodicità comporta un flusso di cariche che concorrono alla corrente residua. Ciò fa sì che la corrente polarografica in funzione del potenziale non possa esser rappresentata da una curva continua, ma da una curva a dente di sega, che rende conto, con le sue periodiche oscillazioni, del continuo formarsi, crescere e staccarsi della goccia di mercurio: soltanto l’inerzia del sistema e alcuni accorgimenti sperimentali impediscono che la corrente oscilli fra un certo valore e lo zero.
La particolare natura dell’elettrodo a goccia di mercurio influenza la corrente polarografica anche da un altro punto di vista: poiché la superficie della goccia è assai piccola, le correnti polarografiche sono sempre molto basse, dell’ordine dei mA. Ciò è un fatto assai rilevante poiché nel tempo generalmente richiesto per un’analisi polarografica, la corrente passata, convertita attraverso le leggi di Faraday dell’elettrolisi in quantità di sostanza trasformata, corrisponde a variazioni di concentrazione della specie elettroattiva tanto basse da poter ritenere costante la concentrazione della specie da dosare; perciò è possibile, sulla stessa aliquota di soluzione, effettuare più prove nelle medesime condizioni della prima, il che è invece impossibile nel caso di un’analisi elettrolitica.
In alternativa all’elettrodo a goccia di mercurio l’elettrodo di lavoro in p. può essere costituito da un filo di platino rotante: in questo caso la corrente di convezione non è nulla ma se, come avviene di fatto, la velocità di rotazione è rigorosamente controllata, tale componente della corrente può considerarsi costante. I due tipi di elettrodo possono essere considerati complementari l’uno dell’altro: infatti per studi anodici, cioè per processi elettrodici di ossidazione, il mercurio non è utilizzabile per via della sua ossidabilità, mentre per processi catodici a potenziali molto negativi, in ambiente acido, il mercurio con la sua sovratensione di idrogeno consente l’analisi e lo studio di sistemi altrimenti inesplorabili per l’interferenza della reazione di riduzione degli idrogenioni. Il secondo elettrodo presente nella soluzione, oltre a quello di lavoro, è un elettrodo impolarizzabile o nel senso più stretto della parola o in un senso meno rigoroso.
P. a tre elettrodi
Nel caso di p. a tre elettrodi, soprattutto impiegata per sistemi organici e ambienti non acquosi, il terzo elettrodo, detto controelettrodo, è in genere un elettrodo di platino: in questo caso fra elettrodo di lavoro e controelettrodo avviene l’elettrolisi, mentre l’elettrodo di riferimento viene utilizzato per definire, a ogni valore della tensione applicata, il corrispondente valore del potenziale dell’elettrodo di lavoro. Poiché l’ossigeno è una specie elettroriducibile, le soluzioni da sottoporre ad analisi polarografica devono essere private di questo interferente in esse sempre presente per l’aria disciolta: ciò viene realizzato facendo gorgogliare prima dell’analisi nella soluzione un gas inerte (per lo più azoto), privo di ossigeno.
Altre tipologie
Alla p. semplice si affiancano tecniche più sofisticate e complesse tra le quali è opportuno ricordare: la p. derivata, nella quale in luogo del diagramma corrente-tensione (i-E) viene registrato il diagramma di/dE in funzione di E sostituendo così ai gradini del polarogramma diretto i picchi del polarogramma derivato: ciò può essere realizzato o con accorgimenti elettronici o con accorgimenti sperimentali; la p. in corrente alternata, nella quale alla normale scansione del potenziale continuo proprio della p. si sovrappone l’imposizione all’elettrodo di lavoro di un potenziale alternato (sinusoidale o a onda quadra) di pochi millivolt: tale tipo di tecnica ha trovato impiego soprattutto per la determinazione delle costanti cinetiche di reazioni in fase eterogenea e per dosaggi a livello di tracce; la p. oscillografica, nella quale tutta l’escursione del potenziale, anziché effettuarsi su un elevato numero di gocce, ciascuna delle quali porta il suo contributo alla corrente e come tale deve essere considerata, ai fini della comprensione del fenomeno della scarica, viene eseguita su una sola goccia e per di più interessando soltanto l’ultima parte della vita di essa; il potenziale applicato alla goccia varia quindi molto velocemente nel tempo e perciò, all’incremento di corrente di tipo esponenziale dovuto alla crescita della goccia, si sovrappongono i fenomeni corrispondenti alle reazioni elettrodiche che, pertanto, assumono una rappresentazione diversa dal gradino polarografico, tanto che un oscillopolarogramma si presenta come un diagramma a picchi. Da esso è tuttavia possibile trarre ugualmente utili informazioni analitiche: il potenziale di picco, infatti, è caratteristico, in un mezzo prefissato, di ogni specie chimica, in analogia al potenziale di semigradino, e la corrente di picco, cioè l’altezza, è nella gran parte dei casi proporzionale alla concentrazione della specie chimica responsabile del picco. Da un punto di vista strettamente sperimentale va rilevato che il metodo oscillopolarografico è caratterizzato da maggiore sensibilità e più elevato potere separatore, ma soprattutto è più rapido, dal punto di vista sia operativo sia elettrochimico, consentendo perciò l’analisi di fenomeni veloci (come cinetiche e adsorbimenti) e l’evidenziazione di specie labili e prodotti intermedi.
Impieghi
Sviluppatasi soprattutto nell’ex Cecoslovacchia (scuola di J. Heyrovskì), la p. fra il 1945 e il 1960 è stata una tecnica di grande impiego per analisi industriali e merceologiche, con riferimento non soltanto al dosaggio di metalli, ma anche di composti organici. Dopo qualche anno di stasi, la produzione di lavori polarografici è ripresa con particolare slancio nel campo degli studi chimico-fisici (determinazione dei coefficienti di diffusione, adsorbimento, potenziali di ossido-riduzione, fenomeni di trasporto, costanti di equilibrio, costanti cinetiche) e degli studi analitici (speciazione, dosaggi di elementi, gruppi funzionali, equilibri di complessazione).