AIDS
Sigla di Acquired Immune Deficiency Syndrome, condizione di deficienza immunitaria che, nella fase conclamata, porta progressivamente a morte il paziente per malattie infettive sovrapposte o tumori. La sindrome, di natura virale, è trasmissibile per via sessuale, trasfusionale o iniettiva e dalla madre contagiata al feto. Le conoscenze sulla sindrome da immunodeficienza acquisita hanno avuto una consistente espansione nel corso degli anni 1990 e i progressi hanno riguardato sia il complesso degli approfondimenti biologico-patogenetici sia gli aspetti epidemiologici, clinici e terapeutici.
Nell’ambito dell’inquadramento epidemiologico e clinico-immunologico delle conseguenze legate all’infezione da HIV (Human Immunodeficiency Virus; ➔ HIV) è possibile definire, dal momento del contagio iniziale, una storia naturale dell’infezione che include una prima fase acuta (nella quale si ha una sindrome simil-mononucleosica), a cui può seguire un lungo periodo di relativa asintomaticità. Si instaura in tal modo il quadro nel linguaggio comune definito impropriamente della sieropositività (apparentemente non si osservano segni clinici, ma il danno biologico progredisce e il paziente, spesso in forma inconsapevole, continua a diffondere il contagio, soprattutto per via sessuale). È bene ricordare che l’intervallo tra momento del contagio (infezione) e comparsa delle manifestazioni cliniche è assai variabile e si può estendere anche fino a 10-15 anni.
Dati epidemiologici
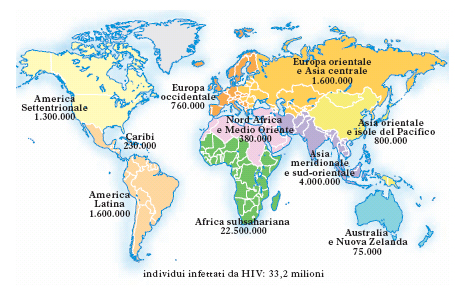
Il sistema di sorveglianza mondiale (Global AIDS surveillance) fornisce periodicamente i dati sulla diffusione dei casi di AIDS nei vari paesi, consentendo l’elaborazione di un quadro sufficientemente realistico del numero di pazienti colpiti e della loro distribuzione geografica (v. fig.). Secondo i dati forniti, dall'inizio dell'epidemia al 2020 hanno contratto l’infezione da HIV 79,3 milioni di individui, e 36,3 milioni sono deceduti a causa di patologie connesse; a fronte di 37,7 milioni di persone affette dal virus, nel 2020 sono stati diagnosticati 1,5 milioni di nuovi casi, numero in contrazione rispetto al picco del 1998 (2,8 milioni di nuovi casi), mentre, grazie alle terapie antiretrovirali combinate, il numero di decessi è in costante flessione, con 680.000 decessi nel 2020 contro gli 1,9 milioni del 2010. Il Consiglio di sicurezza dell’ONU ha decretato l’AIDS un problema che minaccia la sicurezza del mondo. I dati più drammatici riguardano i paesi africani: il 67% dei casi segnalati riguarda l’Africa subsahariana, dove oltre un quarto della popolazione adulta è vittima del contagio.
Struttura e replicazione del virus
Sono noti due virus HIV tra loro correlati, entrambi responsabili dell’AIDS: HIV-1 e HIV-2, che differiscono di poco per alcune caratteristiche. Per comodità espositiva in questo testo si usa l’acronimo HIV, se non altrimenti precisato(la maggior parte degli studi ha riguardato l’HIV-1; l’HIV-2 ha una particolare diffusione nell’Africa occidentale). Il genoma del virus HIV è stato mappato e include geni strutturali e di regolazione. Caratteristicamente l’HIV è un retrovirus perché dotato di un enzima (trascrittasi inversa) in grado di trascrivere RNA virale in DNA. Nel genoma del virus si riconoscono alle estremità due sequenze definite LTR (Long Terminal Repeat); esse svolgono un’azione di promotore ed esercitano il ruolo di siti di combinazione verso la cellula ospite. Nell’ambito LTR si trova un componente (elemento TAR) che svolge un ruolo importante perché si lega con il prodotto del gene Tat, capace di attivare i processi di trascrizione. I geni strutturali sono siglati come gag (codificano per le proteine del nucleocapside), pol (codificano per trascrittasi inversa, integrasi e proteasi) ed env (codificano per la struttura del rivestimento virale con espressione delle molecole gp120 e gp41 necessarie alla fusione dell’HIV con la membrana della cellula bersaglio linfocita T CD4+). L’HIV presenta una struttura icosaedrica caratterizzata da 72 estroflessioni esterne che rappresentano le due maggiori glicoproteine virali (gp120 e gp41). Nella membrana esterna del virus sono anche presenti alcune proteine (antigeni di istocompatibilità) che la particella acquisisce durante la fase di gemmazione attraverso la struttura membranosa della cellula infettata. Il ciclo vitale del virus ha inizio con l’adesione delle particelle virali al recettore specifico rappresentato dalla molecola nota come CD4, propria dei linfociti T ad azione adiuvante (T helper). La struttura del virus HIV che si combina con il recettore è la molecola gp120, il cui processo di fusione è completato dall’ausilio della gp41.
Sono conosciuti vari sottotipi dell’HIV-1: ciascuno di essi è stato isolato in individui provenienti da ben definite regioni geografiche, evidenziando come la diffusione per un determinato genotipo sia caratteristica per ciascun focolaio noto dell’epidemia. L’HIV-1 è coltivato facilmente utilizzando colture di tessuti, e la maggior parte dei ceppi isolati risulta patogena per l’uomo. Tuttavia, la particolare aggressività di un ceppo non è correlata, in generale, con la supposta origine geografica. L’infezione della cellula bersaglio implica due possibili evoluzioni: integrazione genomica e produzione di nuove particelle virali.
Interazione tra HIV e sistema immunitario
Il virus HIV, a differenza di quanto riscontrato per altri retrovirus in animali e nell’uomo, non possiede una specifica funzione trasformante, ma esplica la sua patogenicità svolgendo un ruolo citopatico orientato verso le cellule che esprimono il recettore CD4. Tuttavia, si deve ricordare come altre cellule del sistema monocito-macrofagico e del sistema nervoso centrale possano essere infettate dal virus. Grazie ai progressi della biologia molecolare e a nuove acquisizioni sul significato di molecole regolatrici della risposta immunitaria (citochine), si è osservato che esistono altri recettori (corecettori) che rendono possibile l’ingresso del virus all’interno della cellula bersaglio. Un aspetto fondamentale nella patogenesi del danno immunitario deriva dall’incapacità dell’organismo di liberarsi definitivamente della particella infettante dopo l’ingresso del virus nel citoplasma e la sua integrazione genomica. Questa incapacità può esplicarsi variamente in termini biologici e clinici (infezione latente, evoluzione lenta, evoluzione rapida, riattivazione, disregolazione immunitaria), e non sono ancora del tutto chiariti i momenti critici che rendono possibile una determinata evoluzione del danno biologico in rapporto a condizioni (o all’esistenza di cofattori) che assumono un ruolo scatenante in senso clinico. Senza dubbio, una delle caratteristiche favorevoli al virus è la sua variabilità antigenica: il sistema immunitario non può adeguarsi con efficacia a tale variabilità e pertanto la sua risposta finisce per non essere mai realmente efficiente (per es., gli anticorpi anti-HIV sono prodotti dall’organismo sin dalle prime fasi del contagio, ma essi non sembrano esercitare un convincente ruolo protettivo durante l’infezione stessa). Sebbene siano stati proposti vari modelli in vitro e le osservazioni cliniche siano oggetto di costante attenzione, non sono ancora del tutto noti i meccanismi patogenetici che inducono la perdita dei linfociti CD4. Un’ipotesi riguarda la possibile infezione di cellule midollari che fungono da precursori dei linfociti T CD4+, con forte limitazione dei processi rigenerativi. A questo meccanismo si affianca il ruolo di cellule T a funzione citotossica, in grado di colpire il virus dislocato sui CD4. Meno evidente, ma da non escludersi, è un processo di attivazione anomala delle cellule infettate, che pertanto possono andare incontro alla lisi per meccanismi di apoptosi (➔).
Diagnostica molecolare e monitoraggio del carico virale
La diagnostica dell’infezione si basa sulla individuazione nel paziente contagiato di anticorpi antivirus (evidenziabili con metodiche immunoenzimatiche e con la tecnica del Western blotting, metodica biochimica di separazione per le proteine). Tuttavia i progressi della biotecnologia consentono di dimostrare il contagio delle cellule valutando anche l’integrazione del genoma virale nel patrimonio genetico della cellula infettata. Per questa indagine si applica la tecnica della Polymerase Chain Reaction, o PCR (➔), di tipo qualitativo. Nel corso degli anni 1990, ulteriori progressi sono stati fatti grazie alla disponibilità di tecniche di laboratorio riproducibili che permettono di calcolare il numero delle copie di virus circolanti nel sangue (viral load). La capacità di valutare il danno cellulare (decremento dei linfociti T CD4) e di calcolare le particelle virali presenti nel sangue (carico virale) ha fornito nuove e sostanziali possibilità di monitoraggio della malattia da HIV. Un individuo infettato dal virus è in grado di produrre ca. 10 miliardi di particelle ogni giorno, ed è stato calcolato che la metà delle stesse particelle virali viene sostituita in poche ore nell’arco della giornata. Miliardi di particelle virali vengono quindi distrutte e riprodotte in un arco di tempo relativamente breve (ore) e questo implica un imponente impegno delle sottopopolazioni linfocitarie T CD4+. Pertanto l’uso di un test quantitativo che misuri l’HIV-RNA (acido nucleico del virus nel plasma) è diventato essenziale per poter inquadrare correttamente il paziente sieropositivo e attuare un controllo della risposta individuale ai farmaci antivirali introdotti nei vari protocolli terapeutici. L’entità della viremia plasmatica ha una buona correlazione con la fase replicativa del virus e ha assunto un buon significato prognostico. I due parametri base di controllo, pertanto, sono il numero dei linfociti T CD4 per mm3 circolanti nel sangue periferico e il carico virale. Oltre ai linfociti T CD4+ un ruolo significativo è assunto dalla sottopopolazione dei linfociti T CD8+. I linfociti T CD8+ (citotossici/soppressori) aumentano nelle prime fasi dell’infezione e tendono a incrementare con la progressione della malattia. Lo stato di attivazione cellulare dei linfociti T CD8+ si può evidenziare utilizzando un altro anticorpo monoclonale (rispetto al CD8), in grado di riconoscere sulle cellule una molecola nota come CD38.
Approccio terapeutico
I progressi compiuti nel controllo della malattia da HIV sono stati numerosi e concettualmente rilevanti. In sintesi essi riguardano la messa a punto di una valida strategia antivirale e la migliore gestione farmacologica delle infezioni conseguenti allo stato di depressione immunitaria provocato dal virus. In particolare, dopo il 1995, grazie alla disponibilità di varie molecole antivirali in grado di agire su diverse fasi del ciclo di replicazione virale, e grazie alla disponibilità di metodiche di laboratorio con le quali è possibile seguire la risposta alla terapia, si è assistito a un sostanziale mutamento della prognosi. I farmaci antivirali dei quali si dispone sono distinti in: inibitori nucleosidici della trascrittasi inversa (NRTI, Nucleoside Reverse Transcriptase Inhibitor: zidovudina, didanosina, zalcitabina, stavudina, lamivudina, associazioni di lamivudina e zidovudina); inibitori non-nucleosidici della trascrittasi inversa (NNRTI, Non Nucleoside Reverse Transcriptase Inhibitor: nevirapina, delavirdina); e inibitori delle proteasi (PI, Protease Inhibitor: indinavir, ritonavir, nelfinavir, saquinavir). Mentre la disponibilità di un solo farmaco (AZT: zidovudina, esempio di NRTI), a partire dalla seconda metà degli anni 1980, aveva limiti oggettivi e non permetteva una strategia radicale contro il virus, la possibilità di integrare l’azione di due o più antivirali ha consentito di agire con maggiore efficacia sulla replicazione dell’HIV. Poiché le lesioni a carico del sistema linfatico sono legate alla costante replicazione del virus, è di fondamentale importanza un intervento idoneo a sopprimere nel modo più efficace possibile la moltiplicazione dell’HIV, rallentando l’andamento clinico conseguente al danno biologico e salvaguardando la capacità residua della risposta immunitaria. Pertanto si è reso necessario un più accurato inquadramento della fase acuta dell’infezione (conseguente al contagio iniziale) e sono stati elaborati criteri di riferimento atti a stabilire il tempo di inizio del trattamento e le modalità del monitoraggio. I punti cardine sono la valutazione del carico virale circolante nel sangue periferico (inteso come HIV-RNA), il calcolo del numero dei linfociti T CD4+ per unità di volume e lo stato clinico del paziente. Per rendere omogenee le linee di una corretta procedura terapeutica, varie commissioni di esperti hanno elaborato modelli-guida, allo scopo di ottimizzare i tempi e i modi di somministrazione dei farmaci antivirali disponibili. In generale, quando un paziente viene incluso in terapia per la prima volta, è opportuno utilizzare una triplice associazione di farmaci (per es., un inibitore della proteasi con due farmaci NRTI). È possibile anche l’associazione tra due farmaci NRTI e uno NNRTI. D’altro canto, l’uso di un solo farmaco non è assolutamente ammesso, per la facilità con la quale possono insorgere resistenze virali, e anche l’impiego di due soli antivirali deve essere limitato a particolari condizioni di risposta individuale al trattamento. La rivoluzione del trattamento antivirale si è verificata tra la fine del 1995 e l’inizio del 1996. I risultati sono stati senza dubbio incoraggianti e si sono consolidati negli anni seguenti. Poiché la terapia antivirale ha lo scopo di sopprimere il virus prima che si abbia un’irreversibilità del danno immunitario, l’adozione del trattamento (vera e propria polichemioterapia) viene classificata come HAART (Highly Active Antiretroviral Therapy). Alcuni ricercatori hanno dimostrato che dopo la HAART è possibile una ricostituzione immunologica, anche se parziale, verso antigeni di richiamo. Al successo del trattamento attuato somministrando associazioni di inibitori della trascrittasi inversa e della proteasi ha fatto seguito, dopo circa un biennio dall’inizio dei nuovi protocolli, la segnalazione di effetti collaterali significativi con comparsa di alterazioni metaboliche e l’instaurarsi di un quadro clinico noto come lipodistrofia.
Per quanto riguarda la creazione di un vaccino, essa risulta molto difficile a causa dell’enorme diversità genetica del virus e della difficoltà nell’indurre la formazione di anticorpi neutralizzanti. A partire dalla fine degli anni 1990, l’idea di un approccio vaccinale ha ripreso forza, grazie ad alcuni protocolli che hanno fornito interessanti risultati preliminari. Fondamentale il contributo fornito dagli studi condotti per la progettazione vaccinale nell’ambito della pandemia da Covid-19: al 2021 negli Stati Uniti sono in fase di sperimentazione due vaccini a molecole di mRNA, in grado di trasmettere alle cellule istruzioni per la produzione di una efficace risposta immunitaria.
Disciplina giuridica in Italia
Un programma di interventi urgenti per la prevenzione e la lotta contro l’AIDS è stato stabilito con la l. 135/1° giugno 1990, che ha previsto: l’istituzione di una conferenza nazionale per la lotta contro l’AIDS; il rafforzamento e la realizzazione di reparti ospedalieri destinati alle persone colpite dalla sindrome; il potenziamento dell’assistenza domiciliare; la preparazione di personale specificamente qualificato. La legge ha inoltre previsto la programmazione di attività di prevenzione generale e di protezione dal contagio professionale, e ha dettato regole specifiche di tutela dell’anonimato delle persone per le quali viene accertata l’infezione. Per quanto riguarda la popolazione carceraria, particolarmente colpita dall’infezione da HIV, la l. 231/12 luglio 1999, ha stabilito che non può essere disposta o mantenuta la custodia cautelare in carcere quando l’imputato è persona affetta da AIDS conclamata o da grave deficienza immunitaria. In tali ipotesi il giudice deve disporre la misura degli arresti domiciliari presso un luogo di cura, di assistenza o di accoglienza. Soltanto in casi eccezionali il giudice ha la facoltà di disporre che l’imputato sia condotto in un istituto dotato di reparto attrezzato per la cura e l’assistenza necessarie. Tuttavia, la custodia in carcere non può essere disposta o mantenuta nei casi in cui la malattia si trovi in una fase così avanzata da non rispondere più ai trattamenti disponibili e alle terapie curative.