trapianto
Agraria
Operazione consistente nell’estrarre dal terreno l’apparato radicale di una pianta (di norma cresciuta in semenzaio), eventualmente insieme col pane di terra, e nel collocare la pianta a dimora. Si usa per alcune piante erbacee da orto e da pieno campo come pomodoro, tabacco e anche riso, ma non tutte le specie lo sopportano bene. Esso fa risparmiare, con la semina in semenzaio, lo spazio disponibile, che può essere frattanto adibito ad altra coltura; nel caso del tabacco, che ha semi minuti, il semenzaio favorisce una nascita più regolare che non quella in pieno campo. Nel t. si adopera un cavicchio e, nel caso che ci sia il pane di terra, il trapiantatoio, costituito da una specie di paletta sagomata; quando il t. viene eseguito da macchine trapiantatrici, è detto t. meccanico. In arboricoltura il t. si esegue sia con piante nate da seme sia con quelle provenienti da talee o margotte; l’epoca del t. dipende dalla specie che si trapianta e dal clima: è preferibile l’autunno. Quando si trapiantano alberi più o meno sviluppati, si avvolgono e riparano con paglia o con muschi, legati con una cordicella.
La macchina agricola impiegata per mettere a dimora piantine, tuberi o bulbi si chiama trapiantatrice (o piantatrice). Nelle trapiantatrici semiautomatiche le piantine, sistemate a mano nella tramoggia o entro serbatoi, vengono spinte verso gli organi di distribuzione, uno per ogni solco, costituiti da apposite pinze che le afferrano introducendole nel solco aperto nel terreno; appositi organi chiudono quindi i solchi e comprimono la terra.
Biologia
Il metodo, e la tecnica relativa, che permette di trasferire un abbozzo dell’embrione o un organo o parte di organo dell’adulto in sede diversa dalla normale. La tecnica del t. in embriologia sperimentale ha lo scopo di saggiare la potenzialità di sviluppo e la capacità di differenziamento di un territorio o di un organo quando sia spostato dalla propria posizione naturale e trasferito in altra sede; è altresì finalizzata ad analizzare le influenze che alcuni organi possono esercitare su altri organi con i quali non sono normalmente in connessione. Con questa tecnica sono stati studiati numerosi fenomeni connessi allo sviluppo embrionale, quali l’induzione e la transdeterminazione.
Nella fisiologia e morfologia sperimentale il t. degli organi nell’adulto può servire a riconoscere le attività endocrine di alcuni organi. L’attecchimento di organi, tessuti o cellule trapiantati o innestati (➔ innesto) è un problema che interessa medici e biologi da molti anni, anche se sono soprattutto i progressi nel campo della immunologia che hanno permesso di chiarire molti aspetti del fenomeno. Per molti anni, infatti, per quanto concerne i t., sono stati registrati numerosi insuccessi sia in animali sia nell’Uomo, specialmente prima che si disponesse di ceppi puri di topo, i quali hanno consentito di conoscere le cause del rigetto dei t.; si è visto, infatti, che se si trapianta un tessuto come la cute fra individui dello stesso ceppo puro, cioè geneticamente identici, il tessuto viene nutrito dai vasi dell’ospite, persiste e funziona indefinitamente. Se invece lo stesso t. è praticato a individui di un altro ceppo, cioè geneticamente diversi dal donatore, si osserva rigetto del trapianto. È quindi comprensibile che t. di tessuti scambiati fra individui di una popolazione naturale, come quella umana, in cui ogni individuo è geneticamente diverso dall’altro, vengano rigettati nella maggior parte dei casi. Le cause e le modalità del rigetto dei t. sono state studiate principalmente nel topo e le altre conoscenze acquisite in questa specie sono state confermate in numerose altre specie di animali da laboratorio e nell’Uomo. In tutti i Vertebrati superiori la reazione di rigetto presenta lo stesso quadro istologico, sia per le componenti cellulari, sia per la dinamica della reazione.
Medicina
Trasferimento di un tessuto o di un organo da una regione all’altra dello stesso organismo o da un organismo all’altro della stessa specie o di specie diversa. Prevede l’inserimento dell’organo nel ricevente mediante la confezione di anastomosi vascolari e si distingue quindi dall’innesto, nel quale i tessuti provenienti da un donatore vengono inseriti nel ricevente senza la ricostruzione della loro vascolarizzazione. Con donatore e ospite (o ricevente) si indicano rispettivamente l’organismo che dà e quello che riceve l’organo o il tessuto da asportare e ricollocare in altra sede. L’organo può essere prelevato da un soggetto deceduto (donatore cadavere), oppure da un soggetto vivo (donatore vivente) del gruppo parentale diretto (consanguineo) o non (non consanguineo). Quando il donatore è della stessa specie del ricevente si parla di allotrapianto o omotrapianto; in caso contrario di xenotrapianto. Si denomina autotrapianto il t. di un organo nello stesso ricevente dopo la sua temporanea rimozione dall’organismo per eseguire con chirurgia di banco l’asportazione di un processo neoplastico (rene, fegato) o la riparazione di una lesione (per es., stenosi dell’arteria renale). Si parla infine di t. ortotopico ed eterotopico in relazione alla sede di impianto, rispettivamente uguale o differente da quella fisiologica. Il rigetto è la risposta immunitaria dell’organismo di un ospite che respinge come incompatibile l’organo trapiantato.
Cenni storici
Accenni al t. di organi o tessuti si ritrovano nella mitologia, nelle leggende dei primissimi secoli dopo Cristo (t. di un arto a opera dei santi Cosma e Damiano) e in repertori diversi (innesti di cute in manoscritti indiani del 5° sec. d.C.). Nel 1597 G. Tagliacozzo realizzò per primo un autoinnesto di cute e da allora questa metodica si diffuse ampiamente con progressivi affinamenti di tecniche e di conoscenze. Nel 18° sec. J. Hunter coniò il termine trapianto. Nel 1881 W. Macewen realizzò con successo un allotrapianto di osso. In seguito, grazie anche all’affinamento di tecniche chirurgiche e a numerosi tentativi sull’animale (il primo per opera di E. Ullman, 1902) e sull’Uomo (il primo allotrapianto di rene da cadavere per opera di Y.Y. Voronoij, 1933), si è giunti all’impiego del t. come alternativa terapeutica efficace in molteplici situazioni altrimenti incompatibili con la sopravvivenza. Negli anni 1950 J.E. Murray mise a punto la manipolazione del sistema immunitario di trapiantati renali non consanguinei con il donatore mediante l’impiego dell’irradiazione linfatica totale seguita dal t. di midollo. Nel 1963 a Denver (Colorado) T.E. Starlz eseguì il primo t. di fegato. A coronamento di studi e tentativi effettuati sin dal 1905, nel 1967 a Città del Capo C.N. Barnard realizzò il primo t. di cuore.
Parallelamente allo sviluppo delle metodiche chirurgiche, si assistette all’evoluzione di concetti e tecniche essenziali per il successo del t.: il rigetto, la sua natura immunologica e i presidi dei quali si può disporre per combatterlo. K. Landsteiner, che nel 1900 scoprì il sistema AB0 dei gruppi sanguigni, dimostrò l’importanza della compatibilità fra donatore e ospite fornendo così un importante stimolo a successive ricerche. Inoltre, nel 1913 illustrò l’ipotesi che oltre agli antigeni eritrocitari esistessero antigeni tessutali importanti ai fini della compatibilità dei trapianti. Nel 1936 P. Gorer giunse alla dimostrazione nel topo dell’esistenza di un gruppo di antigeni, codificati da geni localizzati in un’area cromosomica (il complesso maggiore di istocompatibilità), la cui compatibilità fra donatore e ricevente è fondamentale nell’attecchimento del t. di cute. Nel 1944 P.B. Medawar dimostrò sperimentalmente la natura immunologica del rigetto, per i caratteri di specificità e memoria che lo caratterizzano. Il sistema maggiore di istocompatibilità fu descritto anche nell’Uomo nel 1965 da J. Dausset e J.J. van Rood.
Elementi di immunologia
Le differenze individuali alla base del fenomeno del rigetto dell’organo trapiantato derivano dal complesso maggiore di istocompatibilità (MHC, major histocompatibility complex), costituito da una serie di geni localizzati in corrispondenza del braccio corto del cromosoma 6, che codificano la sintesi di alcune glicoproteine di membrana. Queste ultime si dividono in due differenti sottogruppi: il primo corrisponde agli antigeni di classe I, denominati HLA (human leukocyte antigen) A, B e C; il secondo è costituito dagli antigeni di classe II denominati HLA-DR, DQ e DP, presenti solo sulla superficie di macrofagi, linfociti B e T attivati, cellule endoteliali e, in alcuni casi, cellule epiteliali. Entrambe queste classi di antigeni partecipano all’attivazione immunologica cui sono dovuti i fenomeni di rigetto e costituiscono il bersaglio per le cellule citotossiche (HLA-A, B e C) o per i linfociti T helper (HLA-DR, DQ e DP). La reazione immunologica di rigetto viene scatenata dagli antigeni specifici di istocompatibilità del donatore che, attraverso una serie di eventi complessi, vengono riconosciuti come estranei dal ricevente, il cui sistema immunitario reagisce fino a distruggere l’organo trapiantato.
Il rigetto viene classificato in: a) rigetto iperacuto, che avviene immediatamente o entro pochi minuti dalla rivascolarizzazione dell’organo trapiantato; b) rigetto acuto precoce o accelerato, che si verifica nel caso sussista una presensibilizzazione del ricevente, per cui l’organo trapiantato può inizialmente funzionare in modo ottimale, ma presenta rapidamente un deterioramento della sua funzionalità; c) rigetto acuto cellulare, che è la forma di rigetto più tipica e frequente, controllata nella maggior parte dei casi dalla terapia immunosoppressiva; l’aspetto istologico di questo tipo di reazione è inizialmente rappresentato da un’infiltrazione perivascolare di cellule linfoblastiche, mentre negli stadi più avanzati si osservano anche infiltrazione interstiziale, edema, necrosi e passaggio perivascolare di cellule; d) rigetto cronico, che in genere inizia nel corso del primo anno dopo il t. ed è secondario alla lenta produzione di anticorpi umorali che agiscono sulle pareti dei vasi provocando fenomeni di iperplasia con progressiva ostruzione del lume vasale. Mentre non esiste un consenso definitivo circa la necessità di una perfetta compatibilità HLA, in tutti i casi è invece indispensabile la negatività del cross-match diretto, cioè l’assenza di reattività tra il siero del ricevente e i linfociti del donatore. Infatti la presenza di anticorpi preformati comporta l’insorgenza del rigetto iperacuto, con conseguente danneggiamento irreversibile dell’organo trapiantato, non appena questo viene rivascolarizzato.
Principi di immunofarmacologia
Solo alcuni farmaci si sono dimostrati efficaci per la prevenzione e il trattamento del rigetto nel t. di organi. Tra questi l’azatioprina, che agisce inibendo la differenziazione e la proliferazione dei linfociti T e B attivati. I suoi effetti collaterali più importanti sono rappresentati dalla leucopenia marcata con conseguente aumento di rischi di infezioni e dalla epatotossicità. La deplezione linfocitaria può essere indotta nel ricevente mediante la somministrazione di steroidi surrenalici, che agiscono inducendo la migrazione dei linfociti T circolanti dal sangue ai tessuti linfatici; notevoli sono tuttavia gli effetti collaterali, quali ipertensione, alterazioni del metabolismo lipidico e glucidico, osteoporosi e insorgenza di cataratta. Anche l’impiego di radiazioni ionizzanti, soprattutto sotto forma di irradiazione linfatica totale, può ridurre le popolazioni linfocitarie. A tale scopo viene tuttavia più frequentemente utilizzata la somministrazione di globuline antilinfocitarie (ALG, antilymphocytic globulin), efficaci sia per la profilassi sia per la terapia del rigetto. La scoperta della ciclosporina, capostipite di una generazione di farmaci che agiscono in misura maggiore sui linfociti T, prevenendone l’attivazione da parte dell’IL-2 (interleuchina 2) oppure, se il fenomeno si è già verificato, bloccando i linfociti T e impedendo loro di sintetizzare e secernere IL-2, ha significativamente migliorato i risultati del t. di rene, pancreas, fegato, cuore e ha reso applicabili clinicamente quelli di polmone e di intestino. Anche la ciclosporina non è tuttavia priva di effetti collaterali, quali epatotossicità, ipertensione arteriosa, neurotossicità e nefrotossicità, anche se la maggior parte di essi sono dose-dipendenti.
Il perfezionamento dei protocolli immunosoppressivi ha ridotto l’incidenza del rigetto e nello stesso tempo di complicanze infettive dopo t. d’organo. Non è stato tuttavia risolto il problema delle infezioni opportunistiche, causate cioè da microrganismi quali Protozoi (Pneumocystis carinii), miceti (soprattutto Candida albicans e Aspergillus fumigatus) e virus (in particolar modo Cytomegalovirus) che normalmente non sono patogeni, ma lo divengono nei soggetti con diminuite difese immunitarie.
Tipologie di t. di organi
T. di rene
Fu effettuato per la prima volta tra gemelli monocoriali a Boston nel 1954 da Murray mediante una tecnica chirurgica messa a punto dal chirurgo parigino R. Kuss, e realizzata successivamente in tutto il mondo, utilizzando donatori viventi e cadaveri, in una serie crescente di casi. Il t. renale rappresenta la terapia di elezione nei pazienti affetti da insufficienza renale terminale di qualsiasi origine. Gli unici fattori in grado di precludere questo t. sono la presenza di neoplasie maligne o di infezioni sistemiche in atto. Controindicazioni relative sono considerate l’età del ricevente superiore a 60-65 anni e alcune patologie renali che possono recidivare con una frequenza variabile dopo il t., quali la nefropatia diabetica, la porpora di Schönlein-Henoch ecc. I risultati del t. da donatore vivente sono superiori a quelli da donatore cadavere, in quanto l’assenza della fase anossica elimina la comparsa di necrosi tubulare acuta, elemento aspecifico nel favorire l’innesco della reazione di rigetto, permettendo inoltre l’immediata somministrazione di ciclosporina, farmaco potenziamente nefrotossico, con conseguente diminuzione degli episodi di rigetto.
T. di pancreas e innesto di insule pancreatiche
Eseguito per la prima volta da W. Kellog e R. Lilley a Minneapolis nel 1966 con la finalità di prevenire la progressione di alcune gravi complicanze microangiopatiche del diabete giovanile insulinodipendente, quali la retinopatia, è stato caratterizzato da una progressiva evoluzione che ha portato a ottenere una sopravvivenza a 1 anno dal t. superiore all’80% e a 5 anni del 65%. I due aspetti peculiari che hanno condizionato la tecnica chirurgica da adottare possono essere individuati nella scelta della sede del t. e nel trattamento della secrezione esocrina. Va considerato inoltre che generalmente il t. di pancreas viene effettuato in fase di uremia secondaria a nefropatia diabetica e pertanto è associato con t. di rene; il miglioramento dei risultati e il progressivo diminuire sia dei rischi sia degli effetti collaterali della terapia immunosoppressiva hanno indotto a effettuare un crescente numero di trapianti isolati di pancreas. In alcuni casi è stato eseguito con successo il t. segmentario della coda del pancreas da donatore vivente consanguineo (usualmente un genitore), senza rischi sostanziali, correlabili con la procedura di prelievo.
È stato effettuato, con applicazione clinica limitata, l’innesto di insule pancreatiche che vengono generalmente iniettate nel circolo portale del ricevente: in casi di diabete insulinodipendente con associata insufficienza renale o epatica trova indicazione il t. combinato di insule e, rispettivamente, di rene o fegato. Tuttavia, i risultati a distanza, in termini di correzione dell’alterazione metabolica senza somministrazione esogena di insulina, non sono soddisfacenti.
T. di fegato
Dopo il primo t. effettuato nel 1963 a Denver, lo stesso Starzl ottenne il primo successo clinico nel 1967. Solo negli anni 1980, però, grazie ai perfezionamenti sia della tecnica chirurgica sia della terapia immunosoppressiva, l’intervento ha avuto una diffusione sempre maggiore. Le principali indicazioni al t. di fegato sono costituite dalle differenti forme di insufficienza epatica cronica, dai deficit congeniti di enzimi la cui sintesi avviene a livello epatico, dall’insufficienza epatica acuta fulminante di origine virale, tossica o da farmaci, e dalla patologia neoplastica. Le patologie che precludono il t. di fegato sono limitate alle malattie sistemiche e ai tumori epatici o delle vie biliari.
T. di intestino e t. multiviscerale
Le tecniche chirurgiche sono state messe a punto nel cane rispettivamente da Lilley nel 1959 e da Starzl nel 1960; la prima applicazione clinica ebbe luogo nel 1964 a Boston. Il t. di intestino trova la sua principale indicazione nel trattamento della sindrome da intestino corto (quale si definisce la riduzione al di sotto di 20 cm della lunghezza del tratto enterico funzionale). I t. multiviscerali dovrebbero essere limitati a pazienti con neoplasie neuroendocrine localizzate alla loggia sovramesocolica o ai rari casi di sindrome di Gardner con tumori desmoidi che compromettono la vascolarizzazione degli organi addominali.
T. di cuore
Il t. di cuore umano eseguito da Barnard nel 1967 diede inizio a un periodo di intensa attività clinica e di ricerca. I risultati non ottimali comportarono in seguito una progressiva diminuzione degli interventi effettuati, mentre un nuovo impulso derivò nel 1981 dall’introduzione della ciclosporina come base della terapia immunosoppressiva. Costituiscono indicazione all’intervento le forme più gravi di insufficienza cardiaca secondarie a miocardiopatia idiopatica, arteriopatia coronarica, valvulopatie o ad altra patologia. Poiché numerosi pazienti in lista di attesa muoiono prima del t., sono state messe a punto protesi per sostenere la funzione del ventricolo destro o sinistro del cuore o di entrambi, in attesa dell’organo da trapiantare.
T. di polmone
Molto tempo è intercorso tra il primo t. di polmone, effettuato da J. Hardy nel 1963, e il definitivo successo clinico, ottenuto nel 1983 a Toronto da J.D. Cooper. Il t. di polmone singolo trova indicazione in caso di fibrosi polmonare idiopatica, enfisema polmonare oppure ipertensione polmonare primitiva o secondaria (sindrome di Eisenmenger), mentre le forme più gravi di queste patologie e le infezioni polmonari bilaterali, quali bronchiectasie e fibrosi cistica, possono essere trattate con successo mediante il t. di polmone doppio e, nei rari casi di concomitante insufficienza cardiaca, con quello di cuore e polmoni. La notevole riduzione della mortalità perioperatoria è legata a una migliore selezione dei riceventi, alla riduzione delle complicanze infettive, specialmente virali, a una migliore prevenzione e a un trattamento più efficace del rigetto acuto.
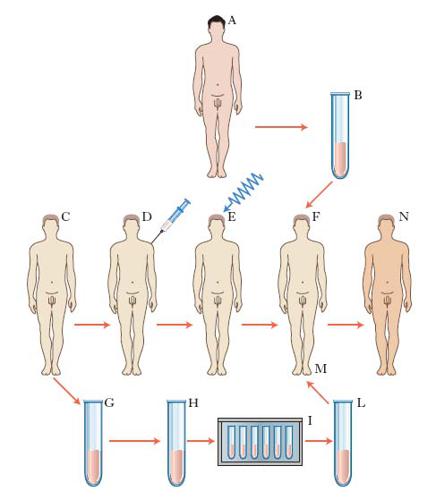
T. di cellule staminali del sangue
Il t. di cellule staminali del sangue (comunemente detto t. di midollo osseo) può essere definito come l’espansione in vivo di cellule primitive raccolte dal midollo osseo o dal sangue circolante, allo scopo di ricostruire il tessuto midollare osseo non più funzionante per effetto di un processo morboso o per azione tossica di farmaci o di radiazioni. Si distinguono due tipi di t. di cellule staminali: quello con reinfusione di cellule autologhe, ottenute dallo stesso paziente, e quello con reinfusione di cellule allogeniche, ottenute da un donatore compatibile (v. fig.). Come donatori devono essere utilizzati preferibilmente i fratelli o, in assenza di fratelli compatibili, donatori di midollo volontari perfettamente compatibili con il ricevente; vengono talora impiegate anche le cellule staminali contenute nel sangue del cordone ombelicale, sempre a condizione che siano compatibili con il ricevente.
L’allotrapianto presenta aspetti sia negativi sia positivi. I primi sono legati, oltre che alla notevole incidenza di complicanze infettive soprattutto virali e all’impiego di radiochemioterapie sovramassimali più immunosoppressive, con notevole rischio di complicanze infettive tardive, alla reazione verso l’ospite, reazione che può insorgere immediatamente dopo l’infusione cellulare o più tardivamente. Gli aspetti positivi sono rappresentati da un effetto da parte delle cellule immunocompetenti del donatore nei confronti della malattia leucemica (reazione contro la leucemia) e ovviamente dall’assenza del rischio legato alla contaminazione delle cellule staminali da reinfondere da parte di cellule neoplastiche, contaminazione che può essere presente se si reinfondono cellule staminali autologhe.
I costi e i rischi connessi con la procedura trapiantologica richiedono che questo tipo di trattamento sia riservato a specifiche malattie: a) sindromi da insufficienza midollare. La perdita totale e persistente della funzione emopoietica midollare può derivare da cause congenite (per es., anemia di Fanconi) oppure acquisite (per es., esposizione accidentale a radiazioni ionizzanti, aplasia midollare su base immunologica). Se è disponibile un donatore HLA identico, il trapianto allogenico può consentire il recupero della funzione midollare; b) leucemie. L’indicazione al t. non è estesa a tutte le forme, perché alcune di esse possono guarire con la sola chemioterapia (per es., leucemia acuta linfoide del bambino, leucemia promielocitica), o perché la malattia può essersi mostrata resistente a qualsiasi forma di chemioterapia ed è quindi da considerarsi ineradicabile. In ogni caso, il paziente va avviato al t. quando è in buone condizioni cliniche, cioè dopo che una chemioterapia adeguata abbia già determinato una regressione di sintomi e segni della malattia. La leucemia mieloide acuta e la leucemia linfoide acuta ad alto rischio sono attualmente le forme in cui più frequentemente si ricorre al t. come terapia di consolidamento dei risultati ottenuti con la chemioterapia. Se non è disponibile un donatore HLA identico e la malattia ha raggiunto una buona remissione con la chemioterapia, nelle leucemie acute può essere utilizzato un approccio autotrapiantologico, utilizzando cellule staminali raccolte nel corso della remissione; c) tumori chemiosensibili. Per pazienti con tumori solidi sensibili alla chemioterapia (per es., linfomi, alcuni carcinomi), che non rispondono completamente alla chemioterapia standard o che recidivano dopo tale terapia, si può tentare di eradicare la malattia neoplastica con citostatici associati a t. autologo (più raramente allogenico) di midollo. Il t. di cellule staminali emopoietiche ha come scopo principale quello di consentire l’uso di dosi molto elevate di citotossici; d) talassemie, emoglobinopatie. In casi gravi di anomalie congenite della produzione di emoglobina (talassemia maggiore, anemia falciforme) il t. allogenico può consentire la produzione di globuli rossi ricchi di emoglobina normale. Naturalmente il beneficio del t. va bilanciato con i rischi connessi alla procedura; e) immunodeficienze congenite, errori congeniti del metabolismo. In questi casi il t. di midollo è utilizzato non per sostituire il tessuto emopoietico, che è normale, ma per creare un sistema immunitario funzionante (nelle immunodeficienze) o per consentire la produzione di enzimi congenitamente carenti. Si tratta in questi casi sempre di trapianto allogenico, da effettuare precocemente, prima che la malattia produca danni irreversibili.
L’età del paziente come fattore limitante all’uso di procedure trapiantologiche si è modificata nel tempo. Oggi si sottopongono ad autotrapianto di midollo pazienti di qualsiasi età, anche dopo i 60 anni; per i trapianti allogenici sono stati disegnati regimi di condizionamento a intensità ridotta che consentono di effettuare questa procedura anche fra i 50 e i 60 anni. Resta l’assunto che le possibilità di successo sono tanto maggiori quanto più giovane è l’età del paziente.
Il t. segue una routine standard composta di tre fasi principali, in cui il paziente viene trattato prima con una chemioterapia al fine di eradicare la malattia presente e di far sì che non vi sia reazione di rigetto immunitario (condizionamento); successivamente avviene la cosiddetta infusione delle cellule staminali, cui segue una procedura di protezione del paziente durante la fase aplastica, quando vi è un forte deficit delle difese immunitarie.
Prospettive
Gli indiscutibili successi registrati, in un arco di tempo relativamente limitato, nel campo dei t. d’organo non devono indurre a trascurare le difficoltà e i problemi ancora non completamente risolti. In un prossimo futuro la terapia genica potrebbe offrire la possibilità di trattare, prima dell’intervento, l’organo sia umano sia animale da trapiantare, permettendo a un vettore virale di penetrare il sito di azione ed evitando nel contempo la risposta immunologica che normalmente si verifica nei confronti del vettore stesso, quando questo viene somministrato mediante via endovenosa. L’impossibilità di sospendere la terapia immunosoppressiva, non ancora del tutto scevra di effetti collaterali anche seri, quali una maggiore incidenza di infezioni e tumori maligni, influenza negativamente la qualità di vita dei trapiantati. A tale proposito una linea di ricerca che appare particolarmente promettente è lo studio del ‘microchimerismo’, cioè della colonizzazione degli organi del ricevente da parte di cellule immunocompetenti provenienti dal donatore. Questo fenomeno è stato osservato in alcuni pazienti sottoposti negli anni 1960 e 1970 a t. di rene o di fegato. Il t. contemporaneo dallo stesso donatore del midollo osseo e del fegato o di un altro organo solido potrebbe infatti indurre nel ricevente un’analoga forma di parziale tolleranza immunologica, che renderebbe possibile la riduzione o addirittura l’eliminazione della terapia immunosoppressiva, senza incorrere in fenomeni di rigetto.
Il problema dell’inadeguata disponibilità di donatori cadaveri può essere risolto dall’utilizzo di organi prelevati a esseri viventi di una specie diversa da quella del ricevente (➔ xenotrapianto).
Legislazione
Il problema del t. presenta aspetti diversi a seconda che avvenga tra due persone vive o a seguito di prelievo da cadavere. Nel primo caso l’art. 5 c.c. (in attuazione del principio secondo cui il consenso dell’avente diritto è giuridicamente rilevante solo in relazione a diritti disponibili), vieta gli atti di disposizione del proprio corpo quando cagionino una diminuzione permanente dell’integrità fisica o quando siano altrimenti contrari alla legge, all’ordine pubblico o al buon costume. Per superare tale ostacolo la l. 458/1967 ha espressamente previsto la deroga all’articolo predetto, ammettendo la disposizione a titolo gratuito del rene ai fini del t. tra persone viventi. È comunemente definito t. anche il prelievo e la successiva infusione di midollo osseo per innesto in individui della stessa specie, pur se con caratteristiche diverse da quelle del ricevente (t. allogenico). In realtà tale intervento non è assimilabile al t., dal momento che non cagiona una diminuzione permanente dell’integrità fisica del soggetto, poiché il tessuto è in grado di rigenerarsi; per tale motivo esso è stato regolato unitamente alle emotrasfusioni nella l. 107/1990, successivamente abrogata (quasi per intero) dalla l. 219/2005. È altresì possibile il t. parziale del fegato (l. 483/1999).
Per il t. di organi prelevati da cadaveri, la materia è regolata dalla l. 91/1999, che ha disciplinato il prelievo a scopo di t. terapeutico di organi e di tessuti da soggetti di cui sia stata accertata la morte ai sensi della l. 578/1993, e ha regolamentato le attività di prelievo e di t. di tessuti e di espianto e di t. di organi, prevedendo che nell’esecuzione dei t. sia assicurato il rispetto dei principi di trasparenza e di pari opportunità tra i cittadini e che i criteri di accesso alle liste di attesa siano determinati da parametri clinici e immunologici. In particolare, tale legge, riconoscendo il principio del silenzio-assenso informato, stabilisce che i cittadini sono tenuti a dichiarare la propria libera volontà in ordine alla donazione di organi e di tessuti successivamente alla morte e devono essere informati del fatto che la mancata dichiarazione di volontà è considerata quale assenso alla donazione. Qualora dai dati inseriti nel sistema informativo dei t. risulti che il soggetto sia stato informato e non abbia espresso alcuna volontà, il prelievo è consentito salvo che, entro il termine corrispondente al periodo di osservazione ai fini dell’accertamento della morte, sia presentata una dichiarazione autografa di volontà contraria al prelievo del soggetto di cui sia accertata la morte. Per i minori di età la dichiarazione di volontà in ordine alla donazione è manifestata dai genitori esercenti la potestà (in caso di mancato accordo non può ritenersi manifestata la disponibilità alla donazione). Non è consentita la manifestazione di volontà in ordine alla donazione di organi per i nascituri, per i soggetti non aventi capacità di agire e per i minori affidati o ricoverati presso istituti di assistenza pubblici o privati. La legge detta anche i principi per l’Organizzazione nazionale dei prelievi e dei trapianti, che è costituita dal Centro nazionale per i t., dalla Consulta tecnica permanente per i t., dai centri regionali o interregionali per i t., dalle strutture per i prelievi, dalle strutture per la conservazione dei tessuti prelevati, dalle strutture per i t. e dalle aziende sanitarie locali. Specifiche disposizioni regolano inoltre l’esportazione e l’importazione di organi e di tessuti e individuano i casi urgenti in cui le spese di t. di organi all’estero sono a carico del Servizio sanitario nazionale.
Aspetti bioetici
I progressi nel campo della medicina dei t. sollevano problemi bioetici, che mettono in gioco i valori dell’identità e della dignità della persona umana. In termini generali, i principi che definiscono il problema etico dei t. d’organo sono: la difesa della vita del donatore e del ricevente; la protezione dell’identità personale; il consenso informato. Il principio del rispetto della vita fisica comporta la non disponibilità del proprio corpo, salvo che per un bene superiore all’integrità del corpo stesso (‘principio di totalità’ o ‘terapeutico’). In particolare, gli autotrapianti sono legittimi quando è necessario disporre di una parte per il bene integrale dell’organismo; i t. omoplastici (di rene, cuore ecc. da uomo a uomo), invece, si giustificano alla luce dei principi di totalità e di solidarietà, sulla base di due condizioni: a) che il donatore vivo non subisca un pregiudizio sostanziale e irreparabile per la propria vita e la propria attività; b) che vi sia una possibilità elevata di riuscita del t. per il ricevente (proporzionalità terapeutica). Dubbia appare pertanto, dal punto di vista bioetico, la liceità di t. che presentino un rischio elevato per il donatore o per il ricevente e che si possano considerare di natura sperimentale nei confronti del ricevente, senza che gli sia garantito un beneficio proporzionato. Il principio terapeutico definisce anche i criteri per la selezione dei pazienti, tenendo conto dei parametri immunologici e clinici di urgenza. Il principio della protezione dell’identità personale si pone in relazione ai t. di organi legati al pensiero e all’identità biologico-riproduttiva del soggetto (t. testa-tronco, t. di organi genitali e di ghiandole che hanno un ruolo specifico nell’equilibrio ormonale e biopsicologico). Per la loro natura sperimentale, questi t. rendono ancora più grave l’illiceità dell’intervento, non essendone noti gli effetti reali sull’individuo e i suoi discendenti. Il principio del consenso informato, infine, implica la decisione anteriore, libera, cosciente e informata, del donatore e del ricevente.